n
第35练 实验操作、现象的描述 定量测定的方法
[分值:50分]
一、实验操作、现象、结论及原因的规范描述
1.(8分)草酸亚铁晶体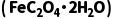 呈黄色,难溶于水,可溶于稀H2SO4,有较强还原性。某化学兴趣小组用下列装置制备草酸亚铁晶体。
呈黄色,难溶于水,可溶于稀H2SO4,有较强还原性。某化学兴趣小组用下列装置制备草酸亚铁晶体。
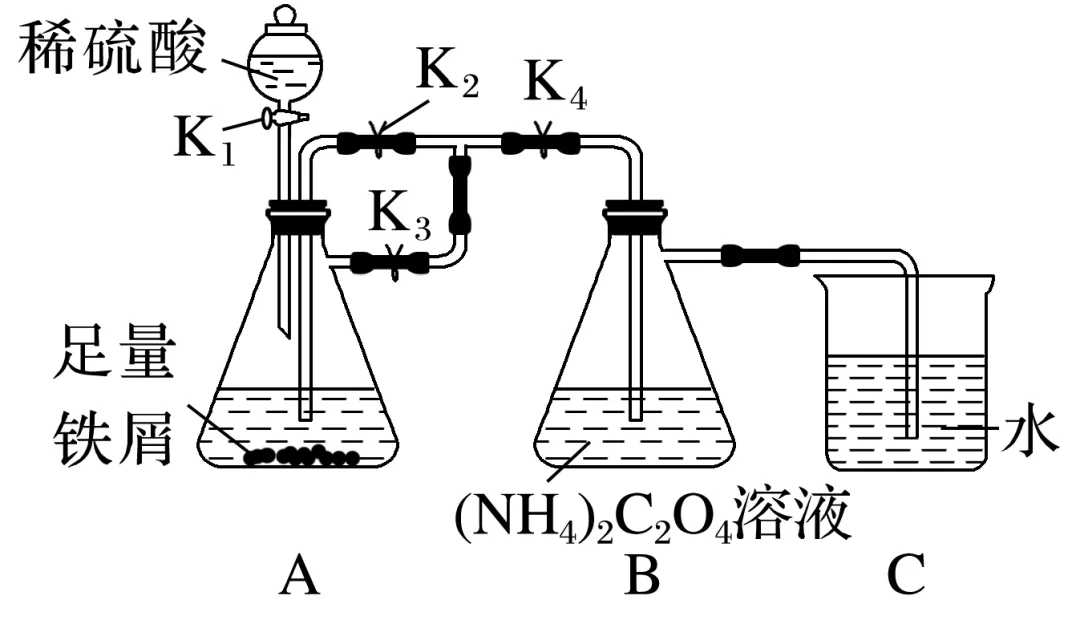
实验步骤如下:
第一步:按图连接好装置,检查装置气密性。
第二步:打开,关闭。
第三步:……
第四步:打开K2,关闭K3,使A中溶液进入到B中进行反应。
第五步:对B中所得沉淀进行过滤、洗涤和干燥可得FeC2O4·2H2O。
(1)请把实验步骤补充完整。
第二步:打开(填“K1”“K2”“K3”或“K4”),关闭。
第三步:。
(2)装置C的作用是。
答案 (1)K1、K3、K4 K2 用试管收集B(或C)中出来的气体并验纯 (2)液封(或防止空气进入装置B中)
解析该实验利用Fe和H2SO4反应生成的H2先将装置中的空气排尽,再通过调节止水夹改变压强,将FeSO4和H2SO4混合液压入装有 C2O4溶液的锥形瓶中,从而得到FeC2O4·2H2O。(1)按图连接好装置,检查装置气密性后,先利用Fe和H2SO4反应生成的H2排尽装置内空气,故应该打开K1、K3、K4,关闭K2;当B(或C)排出的气体全部为H2时,再开始下一步操作,则第三步应该是用试管收集B(或C)中出来的气体并验纯。(2)FeC2O4·2H2O有较强还原性,易被氧化,故装置C的作用是液封,目的是防止外界空气进入装置B。
C2O4溶液的锥形瓶中,从而得到FeC2O4·2H2O。(1)按图连接好装置,检查装置气密性后,先利用Fe和H2SO4反应生成的H2排尽装置内空气,故应该打开K1、K3、K4,关闭K2;当B(或C)排出的气体全部为H2时,再开始下一步操作,则第三步应该是用试管收集B(或C)中出来的气体并验纯。(2)FeC2O4·2H2O有较强还原性,易被氧化,故装置C的作用是液封,目的是防止外界空气进入装置B。
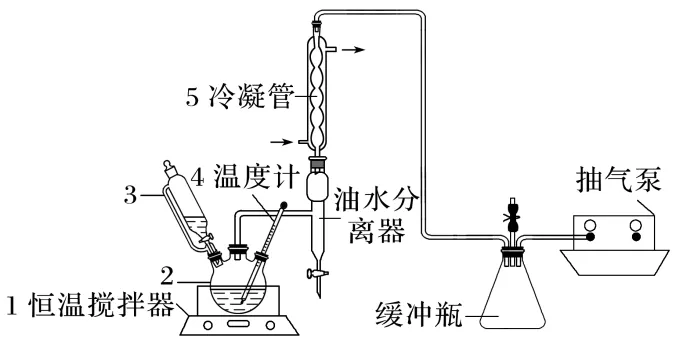
2.(12分)过氧乙酸(CH3COOOH)为无色有刺激性气味液体,易挥发、见光或受热易分解,其纯品极为敏感,易发生爆炸性反应,作为一种常用的消毒剂,过氧乙酸的制备原理为H2O2+CH3COOHCH3COOOH+H2O ΔH<0,实验装置如图。
已知:
物质 | 密度/(g·cm-3) | 熔点/℃ | 沸点/℃ |
乙酸 | 1.05 | 16.6 | 118 |
过氧化氢 | 1.46 | -0.43 | 150.2(分解) |
过氧乙酸 | 0.79 | 0.7 | 105(分解) |
乙酸丁酯 | 0.88 | -78 | 127 |
注意:乙酸丁酯与水形成共沸物(沸点90.7℃),会一起蒸馏出来。
(1)仪器2的名称为,实验中加入乙酸、双氧水、乙酸丁酯和固体催化剂发生反应,仪器3中盛放的试剂为。
(2)反应体系采用抽气泵抽气减压的目的是。
(3)实验过程中打开油水分离器活塞,分离出水的目的是,当观察到现象为,即可停止实验。
(4)乙酸丁酯的作用除了作为过氧乙酸的稳定剂之外,还有。
答案 (1)三颈烧瓶 双氧水 (2)减压可以降低共沸物的沸点,防止温度过高导致过氧乙酸分解
(3)减少水的量,提高过氧乙酸的产率 油水分离器中水不再增加时 (4)降低共沸物的沸点,利于产品蒸出,防止温度过高
解析(1)实验中加入乙酸、双氧水、乙酸丁酯和固体催化剂发生反应,乙酸和过氧化氢反应,乙酸丁酯作有机溶剂,因过氧化氢易分解,故仪器3中盛放的试剂为双氧水,使用恒压滴液漏斗控制双氧水的加入速度提高原料利用率。(4)乙酸丁酯与水形成共沸物的沸点为90.7℃,故乙酸丁酯的作用除了作为过氧乙酸的稳定剂之外,还有降低共沸物的沸点,利于产品蒸出,防止温度过高使过氧乙酸分解的作用。
二、定量实验数据的测定方法
3.(8分)[2024·天津,15(7)(8)(9)]柠檬酸钙[Ca3(C6H5O7)2]微溶于水、难溶于乙醇,是一种安全的食品补钙剂。
Ⅱ.柠檬酸钙样品纯度的测定
已知:柠檬酸钙的摩尔质量为M g·mol-1,EDTA与Ca2+按1∶1(物质的量之比)形成稳定配合物。
将干燥后的柠檬酸钙样品a g置于锥形瓶中,按照滴定要求将其配成试液,用1 mol·L-1 NaOH溶液调节pH大于13,加入钙指示剂,用b mol·L-1的EDTA标准溶液滴定至试液由紫红色变为蓝色,达到滴定终点,消耗EDTA标准溶液V mL。
(7)配制1 mol·L-1NaOH溶液时,需将洗涤烧杯内壁和玻璃棒的洗涤液一并转移至容量瓶中,其目的是。
(8)测定实验中,滴定管用蒸馏水洗涤后,加入EDTA标准溶液之前,需进行的操作为。若滴定所用锥形瓶在使用前洗净但未干燥,会导致测定结果(填“偏高”“偏低”或“无影响”)。
(9)样品中柠檬酸钙质量分数的表达式是(用字母表示)。
答案 (7)减少溶质的损失,减小实验误差 (8)用少量EDTA标准溶液润洗滴定管2~3次 无影响 (9)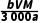 ×100%
×100%
解析(7)配制一定物质的量浓度的溶液,需将烧杯和玻璃棒进行洗涤,将洗涤烧杯内壁和玻璃棒的洗涤液一并转移至容量瓶中,目的是将溶质全部转移至容量瓶中,减少溶质的损失,减小实验误差。(8)滴定管用蒸馏水洗涤后,加入EDTA标准溶液之前,需用EDTA标准溶液对滴定管进行润洗,故操作为用少量EDTA标准溶液润洗滴定管2~3次;滴定所用锥形瓶在使用前洗净但未干燥,这些水分不改变标准溶液和待测液中的溶质,所以对滴定结果无影响。(9)柠檬酸钙的摩尔质量为Mg·mol-1,EDTA与Ca2+按1∶1(物质的量之比)形成稳定配合物,由
3EDTA ~ [Ca3(C6H5O7)2]
3molMg
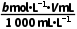 x
x
列比例式可得样品中柠檬酸钙质量x=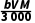 g,样品中柠檬酸钙质量分数的表达式:
g,样品中柠檬酸钙质量分数的表达式: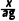 ×100%=
×100%=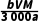 ×100%。
×100%。
4.(12分)(2023·全国乙卷,26)元素分析是有机化合物的表征手段之一。按下图实验装置(部分装置略)对有机化合物进行C、H元素分析。
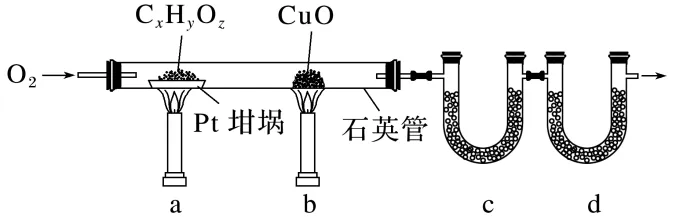
回答下列问题:
(1)将装有样品的Pt坩埚和CuO放入石英管中,先,而后将已称重的U形管c、d与石英管连接,检查。依次点燃煤气灯,进行实验。
(2)O2的作用有。CuO的作用是(举1例,用化学方程式表示)。
(3)c和d中的试剂分别是、(填标号)。c和d中的试剂不可调换,理由是。
A.CaCl2 B.NaCl
C.碱石灰(CaO+NaOH) D.Na2SO3
(4)Pt坩埚中样品CxHyOz反应完全后,应进行操作:。
取下c和d管称重。
(5)若样品CxHyOz为0.023 6 g,实验结束后,c管增重0.010 8 g,d管增重0.035 2 g。质谱测得该有机物的相对分子量为118,其分子式为。
答案 (1)通入一定量的O2 装置气密性 b、a (2)排出装置中的空气,氧化有机物,将生成的CO2和H2O完全赶入U形管中 CO+CuOCu+CO2 (3)A C 碱石灰可以同时吸收水蒸气和二氧化碳 (4)熄灭a处煤气灯,继续通入一定量的O2,熄灭b处煤气灯,冷却至室温,停止通O2
(5)C4H6O4
解析(1)实验前,应先通入一定量的O2排尽石英管中的空气,保证没有其他产物生成,而后将U形管c、d与石英管连接,检查装置气密性,随后先点燃b处煤气灯后点燃a处煤气灯,保证当a处发生反应时产生的CO能被CuO氧化生成CO2。(2)有机物氧化不充分时会生成CO,而CuO可将CO氧化为CO2,反应的化学方程式为CO+CuOCu+CO2。(3)有机物燃烧后生成的CO2和H2O分别用碱石灰和无水CaCl2吸收,其中c管装有无水CaCl2,d管装有碱石灰,二者不可调换,因为碱石灰能同时吸收水蒸气和二氧化碳,影响最后分子式的确定。(5)n(H)=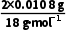 =0.0012mol;n(C)=
=0.0012mol;n(C)=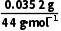 =0.0008mol;n(O)=
=0.0008mol;n(O)=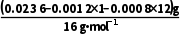 =0.0008mol;该有机物中C、H、O三种元素的原子个数比为0.0008∶0.0012∶0.0008=2∶3∶2;质谱测得该有机物的相对分子量为118,则其分子式为C4H6O4。
=0.0008mol;该有机物中C、H、O三种元素的原子个数比为0.0008∶0.0012∶0.0008=2∶3∶2;质谱测得该有机物的相对分子量为118,则其分子式为C4H6O4。
5.(10分)测定[Co(NH3)x]Cl3中x的值。某小组同学采用如图所示装置进行测定(夹持装置省略)。实验步骤如下:
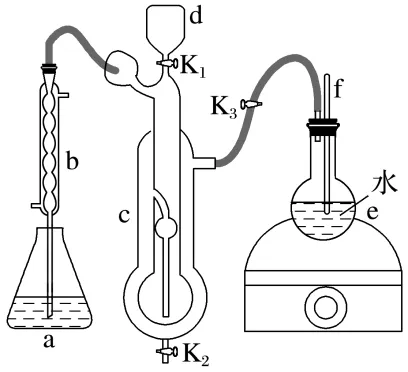
①向a中加入过量的V1 mL c1 mol·L-1的H2SO4溶液;
②打开K1,关闭K2、K3,将含m g [Co(NH3)x]Cl3晶体的溶液和足量NaOH溶液分别由d加入c中,并用蒸馏水冲洗d;
③,并在d中保留少量水;
④加热e,使水蒸气进入c,充分反应;
⑤对a中溶液进行滴定。
(1)将上述步骤③补充完整:。
(2)f的作用为。
(3)步骤⑤中,用c2 mol·L-1 NaOH标准溶液滴定a中的溶液,消耗V2 mL NaOH标准溶液。滴定时选用的指示剂为;[Co(NH3)x]Cl3中x=(用代数式表示)。若步骤②中如果未用蒸馏水冲洗d,会导致所测x的值(填“偏大”“偏小”或“无影响”)。
答案 (1)打开K3,关闭K1 (2)平衡气压 (3)甲基橙 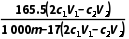 偏小
偏小
解析(1)根据题干信息和分析可知:加入溶液以后,打开K3,关闭K1,对装置e进行加热,使水蒸气进入装置c,带走装置c中的氨气,被装置a中足量稀硫酸完全吸收。(2)f与大气相通,作用为平衡装置中压强,防止装置中压强过大引起事故。(3)用标准溶液滴定a中的溶液,滴定终点得到的溶液为硫酸铵和硫酸钠溶液,硫酸铵溶液水解显酸性,故滴定时选用的指示剂为甲基橙;根据氢氧化钠溶液和稀硫酸反应的关系式:2NaOH~H2SO4,与氢氧化钠溶液反应的n(H2SO4)=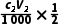 mol,氨气和稀硫酸反应的关系式:2NH3~H2SO4,与NH3反应的n(H2SO4)=(
mol,氨气和稀硫酸反应的关系式:2NH3~H2SO4,与NH3反应的n(H2SO4)=(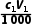 -
-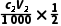 ) mol,则n(NH3)=2(
) mol,则n(NH3)=2(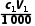 -
-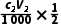 ) mol,则有
) mol,则有
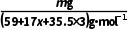 x=2(
x=2(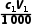 -
-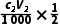 )mol,解得x=
)mol,解得x=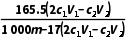 。
。

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享