n
微点突破2 化学反应速率计算与大小的判断
1.化学反应速率的影响因素
(1)利用外因对化学反应速率的影响判断

(2)影响速率的因素中几类特殊情况
温度 | ①催化反应:升高温度,催化剂可能失活,反应速率可能减慢; ②有机反应:升高温度,有可能发生副反应,主反应速率减慢 |
压强 | ①改变非气体反应的压强,反应速率不变; ②改变反应前后气体体积不变的反应的压强,v正和v逆变化幅度相同 |
浓度 | ①固体和纯液体的浓度为定值,改变固体或纯液体的用量,反应速率不变; ②加入固体物质,有可能改变接触面积,反应速率可能加快 |
无关 气体 | ①恒容容器通入无关气体,压强增大,浓度不变,速率不变; ②恒压容器通入无关气体,体积变大,浓度减小,速率减慢 |
 例1 (2024·安徽,12)室温下,为探究纳米铁去除水样中
例1 (2024·安徽,12)室温下,为探究纳米铁去除水样中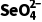 的影响因素,测得不同条件下
的影响因素,测得不同条件下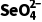 浓度随时间变化关系如下图。
浓度随时间变化关系如下图。
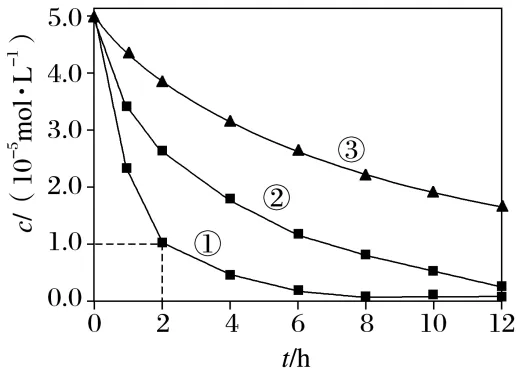
实验序号 | 水样体积/mL | 纳米铁质量/mg | 水样初始pH |
① | 50 | 8 | 6 |
② | 50 | 2 | 6 |
③ | 50 | 2 | 8 |
下列说法正确的是( )
A.实验①中,0~2小时内平均反应速率v(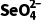 )=2.0 mol·L-1·h-1
)=2.0 mol·L-1·h-1
B.实验③中,反应的离子方程式为:2Fe+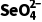 +8H+===2Fe3++Se+4H2O
+8H+===2Fe3++Se+4H2O
C.其他条件相同时,适当增加纳米铁质量可加快反应速率
D.其他条件相同时,水样初始pH越小,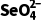 的去除效果越好
的去除效果越好
答案 C
解析实验①中,0~2小时内平均反应速率v(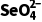 )=
)=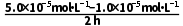 =2.0×10-5mol·L-1·h-1 ,A不正确;实验③中水样初始pH=8,溶液显弱碱性,发生反应的离子方程式中不能用H+配电荷守恒,B不正确;由实验①和②可知,在相同时间内,实验①中
=2.0×10-5mol·L-1·h-1 ,A不正确;实验③中水样初始pH=8,溶液显弱碱性,发生反应的离子方程式中不能用H+配电荷守恒,B不正确;由实验①和②可知,在相同时间内,实验①中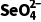 浓度的变化大,因此其他条件相同时,适当增加纳米铁质量可加快反应速率,C正确;由实验②和③可知,在相同时间内,实验②中
浓度的变化大,因此其他条件相同时,适当增加纳米铁质量可加快反应速率,C正确;由实验②和③可知,在相同时间内,实验②中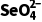 浓度的变化大,因此其他条件相同时,适当减小水样初始pH,的去除效果较好,但是当初始pH太小时,H+浓度太大,纳米铁与H+反应速率加快,会导致与
浓度的变化大,因此其他条件相同时,适当减小水样初始pH,的去除效果较好,但是当初始pH太小时,H+浓度太大,纳米铁与H+反应速率加快,会导致与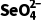 反应的纳米铁减少,因此,初始pH越小,
反应的纳米铁减少,因此,初始pH越小,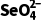 的去除效果不一定越好,D不正确。
的去除效果不一定越好,D不正确。
 例2 以基元反应:A(g)+B(g)C(g) ΔH<0为例。分析图像,比较指定点的反应速率大小。
例2 以基元反应:A(g)+B(g)C(g) ΔH<0为例。分析图像,比较指定点的反应速率大小。
(1)
上图中a、b、c、d四点的反应速率由大到小的顺序为。
答案vd>va>vb>vc
解析虚线是等温线,由于Td>Ta=Tb=Tc且pd=pa>pb>pc,因此vd>va>vb>vc。
(2)
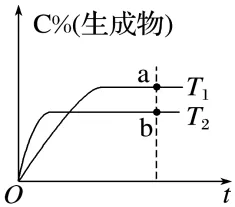
上图中T1、T2温度的大小关系:,a、b两点的反应速率大小关系:。
答案T2>T1vb>va
解析先根据达到平衡的时间推导速率的大小(先拐先平速率大),并根据速率的大小推导温度的高低。
2.平衡前后反应速率的比较
平衡前,Q<K,v正>v逆;平衡时,Q=K,v正=v逆;平衡后,Q>K,v正<v逆。
 例3 利用CO2催化加氢可制乙烯,反应为2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH,在两个容积均为1 L的恒容密闭容器中,分别加入2 mol CO2、4 mol H2,分别选用两种催化剂,反应相同时间,测得CO2转化率(α)随反应温度的变化如图所示。
例3 利用CO2催化加氢可制乙烯,反应为2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH,在两个容积均为1 L的恒容密闭容器中,分别加入2 mol CO2、4 mol H2,分别选用两种催化剂,反应相同时间,测得CO2转化率(α)随反应温度的变化如图所示。
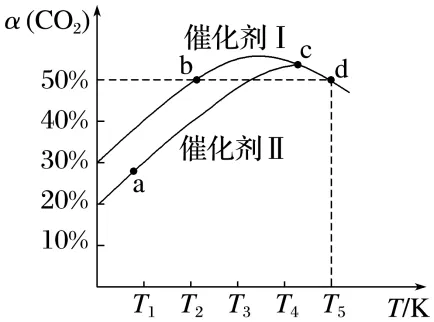
(1)相同温度下发生上述反应,反应的活化能较大的是催化剂,判断的理由:。
(2)a、b、c、d四点的速率由大到小的顺序为。
(3)d点状态下,保持其他条件不变,向容器中再加入1 mol CO2与0.5 mol C2H4,v正(填“>”“<”或“=”)v逆。
答案 (1)Ⅱ 使用催化剂Ⅰ时,先达到平衡,因此催化剂Ⅰ的活化能比催化剂Ⅱ低 (2)vd>vc>vb>va
(3)>
解析(3)d点处于平衡状态,由题意可列出三段式:
2CO2(g)+6H2(g) 2H4(g)+ 4H2O(g)
2H4(g)+ 4H2O(g)
起始/(mol·L-1) 2400
转化/(mol·L-1) 130.52
平衡/(mol·L-1) 110.52
T5K时该反应的平衡常数K=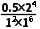 =8,d点状态下,保持其他条件不变,向容器中再加入1molCO2与0.5molC2H4,Q=
=8,d点状态下,保持其他条件不变,向容器中再加入1molCO2与0.5molC2H4,Q=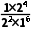 =4<K,反应正向进行,v正>v逆。
=4<K,反应正向进行,v正>v逆。
3.大学教材信息题——速率与速率常数应用
 例4 1889年,ArrHenius提出反应速率常数k随温度的变化关系ln k=-
例4 1889年,ArrHenius提出反应速率常数k随温度的变化关系ln k=-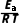 +C(R、C均为常数)。已知2NO(g)+O2(g)2NO2(g),经历反应1和反应2两步。
+C(R、C均为常数)。已知2NO(g)+O2(g)2NO2(g),经历反应1和反应2两步。
反应1:2NO(g)N2O2(g) ΔH1=-46.3 kJ·mol-1
反应2:N2O2(g)+O2(g)2NO2(g) ΔH2=-65.7 kJ·mol-1
两步反应的活化能:Ea1<Ea2。某课题组通过实验绘制出两步反应ln K、ln k随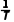 的变化曲线如图所示(K表示平衡常数)。
的变化曲线如图所示(K表示平衡常数)。
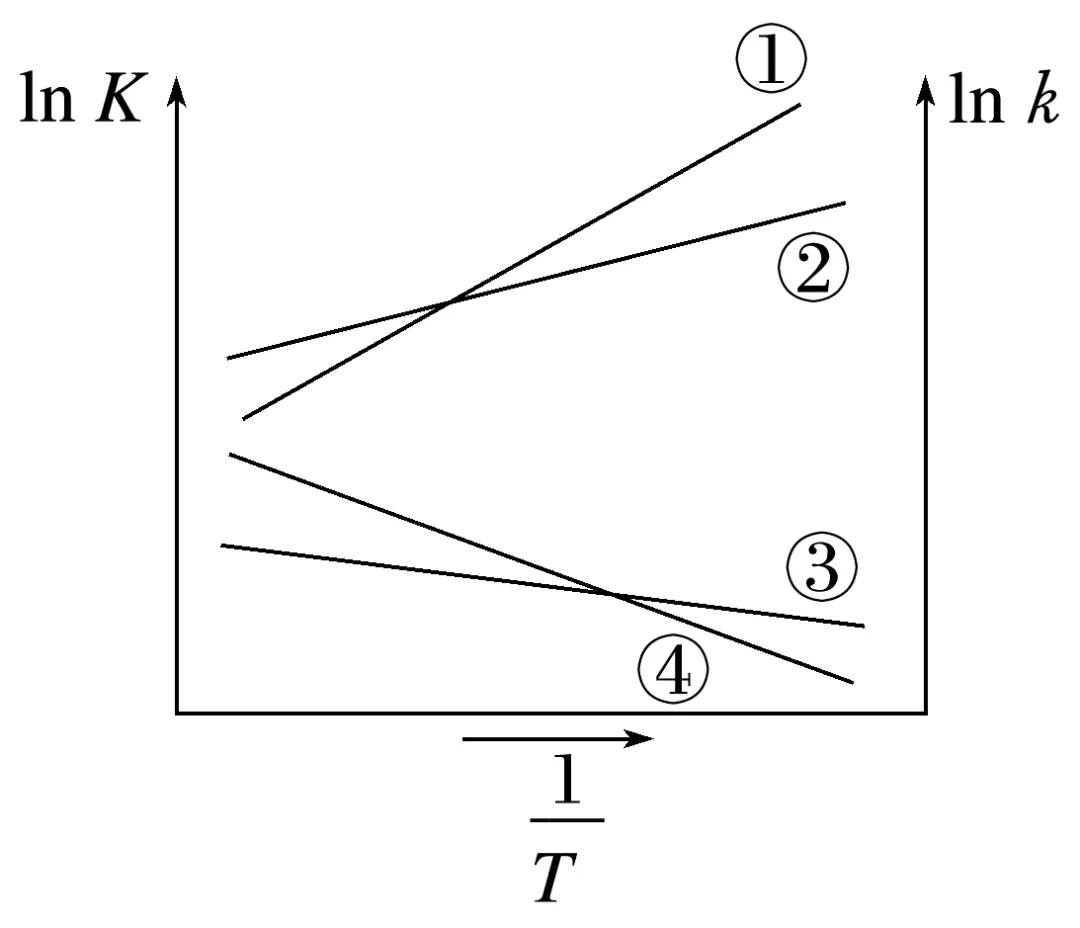
(1)曲线①、②表示的含义:。
(2)曲线④表示的含义:。
(3)相同条件下,O2、NO浓度的变化对反应速率影响更明显的是。
答案 (1)曲线①、②分别表示反应②、反应①的ln K随温度变化的曲线
(2)曲线④为ln k2随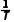 的变化关系
的变化关系
(3)O2浓度的变化
解析(3)反应2活化能较大,是决速步骤,反应2与NO的浓度无关,因而O2浓度的变化对反应速率影响更明显。

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享