n
第5练 陌生物质结构与性质的关系
[分值:50分]
(1~10题,每小题5分)
1.(2025·河南创新发展联盟一模)物质结构决定性质,性质决定用途。下列有关物质结构与性质或性质与用途的叙述正确且具有对应关系的是( )
A.Na2S水解显碱性,用Na2S除去废水中的Cu2+
B.O3分子的空间结构为V形,O3是极性分子
C.K3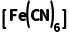 为配合物,可检验溶液中是否存在Fe2+
为配合物,可检验溶液中是否存在Fe2+
D.浓硫酸具有强腐蚀性,用浓硫酸刻蚀石英晶体制备工艺品
答案 B
解析用Na2S除去废水中的Cu2+,是因为Cu2++S2-===CuS↓,与Na2S水解显碱性无关,A错误;具有相同价层电子数和相同原子数的分子或离子是等电子体,等电子体成键方式和空间结构往往相同,SO2中心原子孤电子对数=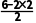 =1,价层电子对数=2+1=3,故为sp2杂化,空间结构为V形,为极性分子,臭氧与二氧化硫是等电子体,则O3分子的空间结构为V形,O3是极性分子,B正确;将K3
=1,价层电子对数=2+1=3,故为sp2杂化,空间结构为V形,为极性分子,臭氧与二氧化硫是等电子体,则O3分子的空间结构为V形,O3是极性分子,B正确;将K3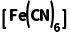 溶液滴入含Fe2+的溶液中:K++Fe2++
溶液滴入含Fe2+的溶液中:K++Fe2++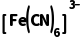 ===KFe
===KFe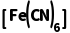 ↓,产生蓝色沉淀,可检验溶液中是否存在Fe2+,与K3
↓,产生蓝色沉淀,可检验溶液中是否存在Fe2+,与K3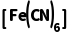 为配合物无关,C错误;氢氟酸能腐蚀玻璃,用氢氟酸而不是浓硫酸刻蚀石英晶体制备工艺品,与浓硫酸的强腐蚀性无关,D错误。
为配合物无关,C错误;氢氟酸能腐蚀玻璃,用氢氟酸而不是浓硫酸刻蚀石英晶体制备工艺品,与浓硫酸的强腐蚀性无关,D错误。
2.(2025·湖南一模)X、Y、Z、W、Q为原子序数逐渐增大的短周期元素,其中X、Y、Q处于不同周期,W、Q同主族。五种元素中,Z的基态原子中未成对电子数最多。现有这些元素组成的两种单体Ⅰ、Ⅱ,通过三聚可分别得到如图(图中未区别标示出单、双键)所示的环状物质(a)和(b)。下列说法错误的是( )
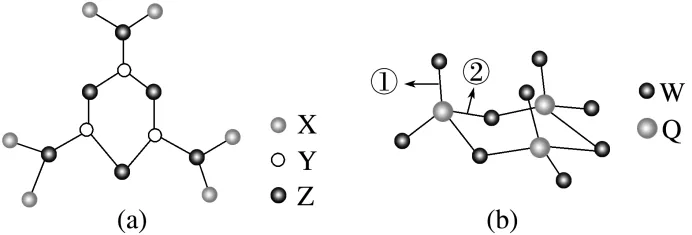
A.第一电离能:Z>W>Y
B.单体Ⅰ中Y原子为sp杂化
C.物质(b)中键长:①>②
D.单体Ⅱ为非极性分子
答案 C
解析 X、Y、Z、W、Q为原子序数逐渐增大的短周期元素,X、Y、Q处于不同周期,X为H元素,Y为第二周期元素,Q为第三周期的元素,由图可知,Z周围形成三个共价键,Z的基态原子中未成对电子数最多,则Z为N元素,Y和Z形成的环状结构中,存在大π键,则Y为C元素,物质(a)为NH2CN的三聚体;由图可知,W形成2个键,W与Q同主族,W为O元素,Q为S元素,物质(b)是SO3的三聚体。
同周期元素第一电离能从左到右逐渐增大,N原子2p轨道处于半充满稳定状态,第一电离能:N>O>C,A正确;单体Ⅰ的结构简式为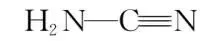 ,存在碳氮三键,C的杂化方式为sp杂化,B正确;物质(b)中①为S==O双键,②为S—O单键,双键键长小于单键键长,键长:①<②,C错误;单体Ⅱ为SO3,中心原子为S,其价层电子对数为3+
,存在碳氮三键,C的杂化方式为sp杂化,B正确;物质(b)中①为S==O双键,②为S—O单键,双键键长小于单键键长,键长:①<②,C错误;单体Ⅱ为SO3,中心原子为S,其价层电子对数为3+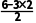 =3,孤电子对数为0,空间结构为平面正三角形,正、负电荷中心重合,为非极性分子,D正确。
=3,孤电子对数为0,空间结构为平面正三角形,正、负电荷中心重合,为非极性分子,D正确。
3.(2025·辽宁抚顺二模)离子液体(或称离子性液体)是指全部由离子组成的液体,离子液体可以用作有机合成的溶剂和催化剂,在生物化学等科研领域也有广泛应用。1⁃丁基⁃3⁃甲基咪唑四氟硼酸盐是一种离子液体,其结构如图所示,下列说法错误的是( )
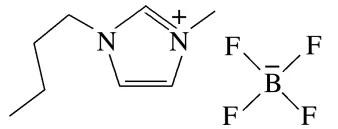
A.离子液体常温下具有导电性,可用作原电池的电解质
B.结构中所有碳原子均共面
C.该物质的化学式为[C8H15N2]+[BF4]-
D.此物质不能溶于苯
答案 B
解析离子液体指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成,故室温下能导电,可用作原电池的电解质,A正确;分子中存在4个直接相连的饱和碳原子,所有碳原子不共面,B错误;由结构可知,该物质的化学式为[C8H15N2]+[BF4]-,C正确;离子液体是指全部由离子组成的液体,而苯为有机溶剂,故物质不能溶于苯,D正确。
4.(2025·山东菏泽模拟)AlCl3、AlBr3水解均可得到Al(OH)3胶体,还可形成二聚体。Al2Br6()的四方晶胞如图所示(各棱长不相等,棱边夹角为90°,Al2Br6在棱心)。下列说法错误的是( )
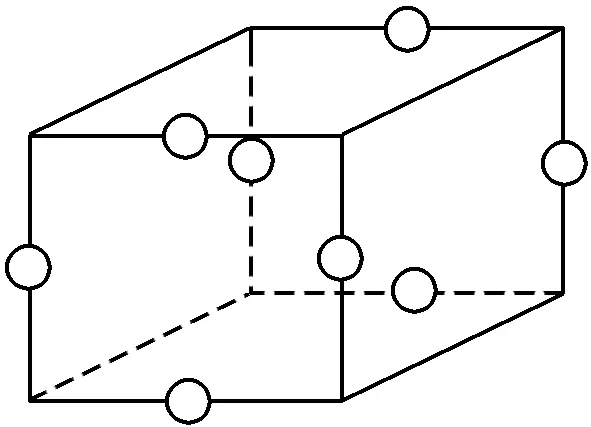
A.AlCl3沸点低于AlBr3
B.AlBr3分子中存在配位键
C.Al(OH)3胶体粒子的平均直径可能是1×10-6 m
D.晶体中与Al2Br6最近且距离相等的Al2Br6有4个
答案 C
解析二者均为分子晶体,随相对分子质量增大(由Cl到Br),分子间作用力增强,故AlCl3的沸点低于AlBr3,A正确;AlBr3常以二聚体Al2Br6形式存在,二聚体中Br原子以配位键桥联两个Al原子,B正确;胶体粒子直径范围为1~100nm(即1×10-9~1×10-7m),故C错误;由所给的晶胞示意图可知,每个Al2Br6单元在晶体中与其最近且距离相等的同类单元共有4个,D正确。
5.(2025·四川眉山一模)黑磷和有机“纳米小人”风靡全球,黑磷具有与石墨相似的层状结构,其结构如图所示。下列分析错误的是( )
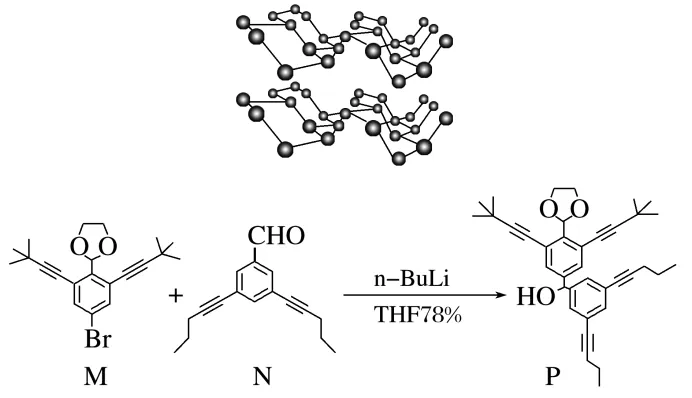
A.黑磷中既存在非极性共价键又存在范德华力,黑磷的熔点高于白磷
B.化合物P中一定共平面的原子有16个
C.黑磷中P原子杂化方式为sp3
D.第三周期只有Cl元素的第一电离能大于P
答案 D
解析黑磷中P与P之间存在非极性共价键,层与层之间存在范德华力,黑磷分子的相对分子质量远大于白磷,产生的范德华力较大,故黑磷的熔点高于白磷,A正确;苯环和碳碳三键上的所有原子都共面,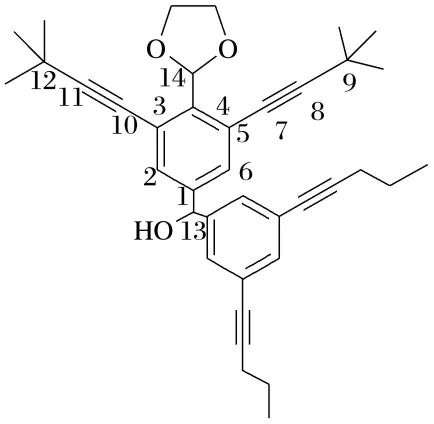 ,如图所示14个碳原子一定共面,2和6处碳原子还连接两个氢原子,也一定与苯环共面,一共16个原子共面,B正确;黑磷结构中P原子连接为空间立体结构,故P原子杂化方式为sp3,C正确;第三周期中Ar与Cl的第一电离能都大于P的第一电离能,D错误。
,如图所示14个碳原子一定共面,2和6处碳原子还连接两个氢原子,也一定与苯环共面,一共16个原子共面,B正确;黑磷结构中P原子连接为空间立体结构,故P原子杂化方式为sp3,C正确;第三周期中Ar与Cl的第一电离能都大于P的第一电离能,D错误。
6.(2025·四川德阳模拟)我国科学家房喻院士成功研发杯[4]吡咯纳米膜(熔点:-23.5 ℃)的制备方法。杯[4]吡咯分子结构如图所示,结构中含有四个吡咯单元(吡咯的结构简式为,分子中所有原子共平面,波浪线表示修饰基团)。下列说法正确的是( )
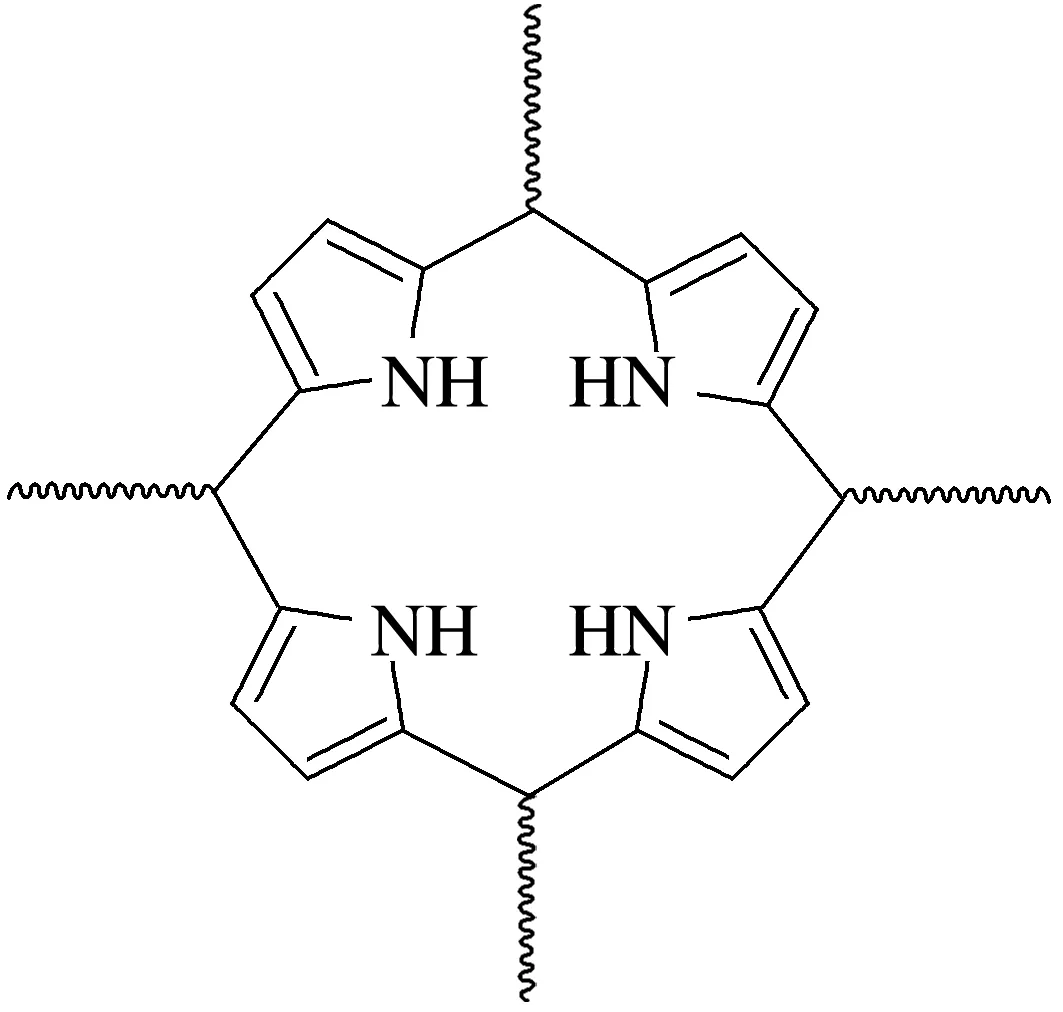
A.杯[4]吡咯纳米膜属于共价晶体
B.吡咯分子中N原子的杂化方式为sp3
C.杯[4]吡咯分子结合卤素离子形成的是超分子
D.溶于水的吡咯分子不能与水分子形成水合分子
答案 C
解析由题意可知,该分子熔点低,因此该分子为分子晶体,A错误;杯[4]吡咯分子中所有原子共平面,则吡咯分子中所有原子也共平面,因此吡咯分子中的N原子杂化方式是sp2,B错误;杯[4]吡咯分子及其衍生物与阴离子的结合能相对较大,因此可以结合卤素离子形成超分子,C正确;吡咯分子中存在N—H,能与水分子间形成氢键,吡咯分子通过氢键与水分子相互作用,形成水合物,D错误。
7.(2025·浙江诸暨高三模拟)硼原子具有缺电子的特性,与N、H可形成,其中B—N为配位键。下列说法不正确的是( )
A.BCl3易水解,生成H3BO3和HCl
B.乙硼烷(B2H6)的结构为
C.H3BO3为一元弱酸,其电离方程式为B(OH)3+H2OB(OH +H+
+H+
D.N(CH3)3为极性分子,空间结构与NH3相似;N(SiH3)3为非极性分子,故可推测其碱性(碱性:结构中有孤电子对,能接受H+)比N(CH3)3弱很多
答案 B
解析三氯化硼在溶液中易发生水解反应,水分子中的1个O—H断裂,B原子与3个—OH结合为硼酸,H原子与Cl原子结合为HCl,故A正确;由共价键的饱和性和硼原子具有缺电子的特性可知,乙硼烷的结构为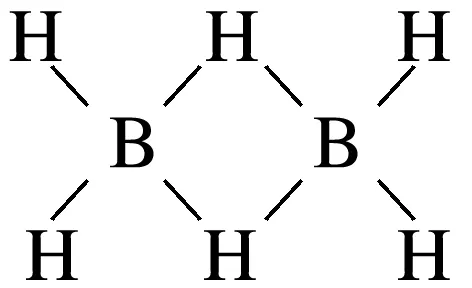 ,故B错误;一元弱酸硼酸在溶液中能与水电离出的氢氧根离子结合生成四羟基合硼酸根离子而使溶液呈酸性,电离方程式为B(OH)3+H2OB(OH
,故B错误;一元弱酸硼酸在溶液中能与水电离出的氢氧根离子结合生成四羟基合硼酸根离子而使溶液呈酸性,电离方程式为B(OH)3+H2OB(OH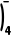 +H+,故C正确;N(CH3)3为极性分子,中心N原子采取sp3杂化,孤电子对占据sp3杂化轨道,方向性明确,空间位阻较小,易于接受H+,而N(SiH3)3为非极性分子,中心N原子采取sp2杂化,孤电子对占据p轨道,离—SiH3较近,且—SiH3基团体积远大于—CH3,使得3个—SiH3在N周围形成较大的空间位阻,孤电子对难以接受H+,所以N(SiH3)3的碱性比N(CH3)3弱很多,故D正确。
+H+,故C正确;N(CH3)3为极性分子,中心N原子采取sp3杂化,孤电子对占据sp3杂化轨道,方向性明确,空间位阻较小,易于接受H+,而N(SiH3)3为非极性分子,中心N原子采取sp2杂化,孤电子对占据p轨道,离—SiH3较近,且—SiH3基团体积远大于—CH3,使得3个—SiH3在N周围形成较大的空间位阻,孤电子对难以接受H+,所以N(SiH3)3的碱性比N(CH3)3弱很多,故D正确。
8.(2025·嘉兴高三模拟)氯化铍在气态时存在BeCl2分子(a),固态时存在长链状分子(b)。下列说法不正确的是( )
A.分子(a)属于非极性分子
B.分子(b)的结构可能是
C.电解熔融氯化铍制备金属铍时,加入氯化钠可以以增强熔融氯化铍的导电性
D.BeCl2与过量NaOH溶液反应生成呈正四面体的阴离子[Be(OH)4]2-
答案 B
解析 BeCl2中心原子Be的价层电子对数为2+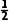 ×(2-2×1)=2,且不含孤电子对,空间结构为直线形,正、负电荷中心重合,为非极性分子,A正确;BeCl2固态时存在长链状分子,该分子中Be原子提供空轨道,Cl原子提供孤电子对形成配位键,结构可能是
×(2-2×1)=2,且不含孤电子对,空间结构为直线形,正、负电荷中心重合,为非极性分子,A正确;BeCl2固态时存在长链状分子,该分子中Be原子提供空轨道,Cl原子提供孤电子对形成配位键,结构可能是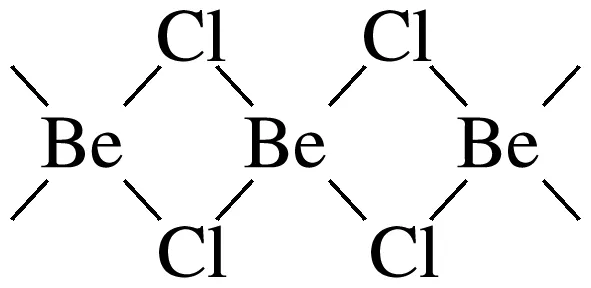 错误;熔融氯化钠中含有自由移动的钠离子和氯离子,能够导电,电解熔融氯化铍制备金属铍时,加入氯化钠可以增强熔融氯化铍的导电性,C正确;根据“对角线”规则,Be和Al的性质相似,BeCl2与过量NaOH溶液反应生成呈正四面体的阴离子[Be(OH)4]2-,D正确。
错误;熔融氯化钠中含有自由移动的钠离子和氯离子,能够导电,电解熔融氯化铍制备金属铍时,加入氯化钠可以增强熔融氯化铍的导电性,C正确;根据“对角线”规则,Be和Al的性质相似,BeCl2与过量NaOH溶液反应生成呈正四面体的阴离子[Be(OH)4]2-,D正确。
9.(2025·北京房山区高三模拟)用放射性同位素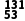 I标记酪氨酸,可达到诊断疾病的目的。标记过程如下:
I标记酪氨酸,可达到诊断疾病的目的。标记过程如下:
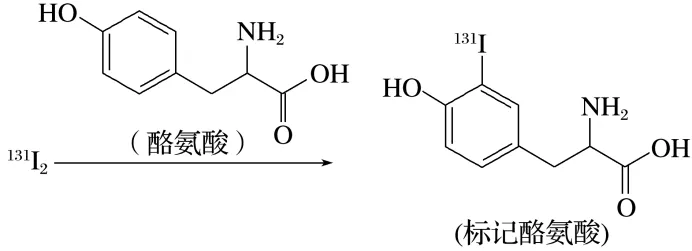
下列说法不正确的是( )
A.I元素位于元素周期表p区
B.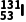 和
和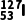 互为同位素
互为同位素
C.酪氨酸苯环上的一碘代物有4种
D.标记过程发生了取代反应
答案 C
解析 I元素位于元素周期表第ⅦA族,最外层

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享