n
第25练 电解质溶液中归因分析、平衡常数计算问题
[分值:50分]
[真题专练]
1.(4分)[2023·全国乙卷,27(3)]LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
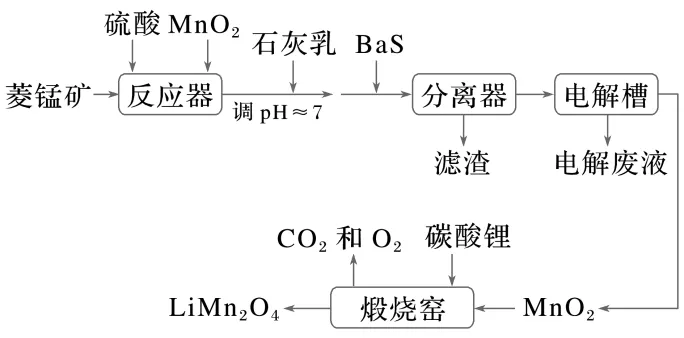
已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是。
答案 2.8×10-9 Al3+
解析溶液pH=4,此时溶液中c(OH-)=1.0×10-10mol·L-1,c(Fe3+)=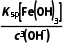 =2.8×10-9mol·L-1,溶液中的c(Fe3+)小于1.0×10-5mol·L-1,认为Fe3+已经沉淀完全;同理,pH≈7,c(OH-)=1.0×10-7mol·L-1,c(Al3+)=1.3×10-12mol·L-1,c(Ni2+)=5.5×10-2mol·L-1,Al3+沉淀完全。
=2.8×10-9mol·L-1,溶液中的c(Fe3+)小于1.0×10-5mol·L-1,认为Fe3+已经沉淀完全;同理,pH≈7,c(OH-)=1.0×10-7mol·L-1,c(Al3+)=1.3×10-12mol·L-1,c(Ni2+)=5.5×10-2mol·L-1,Al3+沉淀完全。
2.(6分)[2022·全国乙卷,26(1)(2)]废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量Ba、Fe、Al的盐或氧化物等,为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
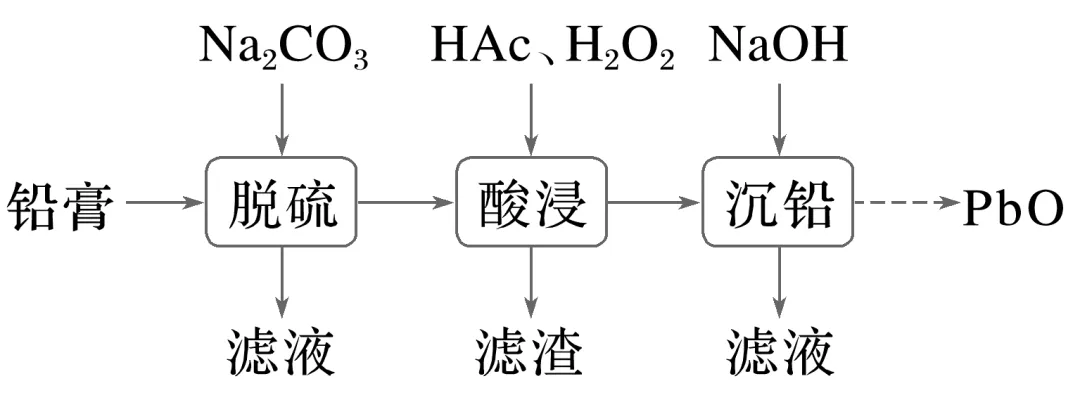
一些难溶电解质的溶度积常数如下表:
难溶电解质 | PbSO4 | PbCO3 | BaSO4 | BaCO3 |
Ksp | 2.5×10-8 | 7.4×10-14 | 1.1×10-10 | 2.6×10-9 |
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Pb(OH)2 |
开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中PbSO4转化反应的离子方程式为,
用沉淀溶解平衡原理解释选择Na2CO3的原因:。
(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,原因是。
答案 (1)PbSO4(s)+C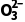 (aq)PbCO3(s)+S
(aq)PbCO3(s)+S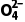 (aq) 反应PbSO4(s)+C
(aq) 反应PbSO4(s)+C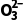 (aq)PbCO3(s)+S
(aq)PbCO3(s)+S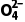 (aq)的平衡常数K=
(aq)的平衡常数K=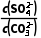 =
=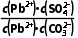 =
=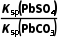 ≈3.4×105>105,PbSO4可以比较彻底地转化为PbCO3
≈3.4×105>105,PbSO4可以比较彻底地转化为PbCO3
(2)反应BaSO4(s)+C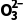 (aq)BaCO3(s)+S
(aq)BaCO3(s)+S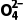 (aq)的平衡常数K=
(aq)的平衡常数K=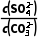 =
=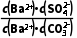 =
=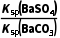 ≈0.04≪105,反应正向进行的程度有限
≈0.04≪105,反应正向进行的程度有限
3.(8分)[2024·海南15(1)(2)(3)(5)]锰锌铁氧体(MnxZn1-yFe2O4)元件是电子线路中的基础组成部分。某实验室利用废弃电子产品中的锰锌铁氧体制备MnO2、ZnO和FeC2O4·2H2O,可用于电池、催化剂等行业,其工艺流程如下:
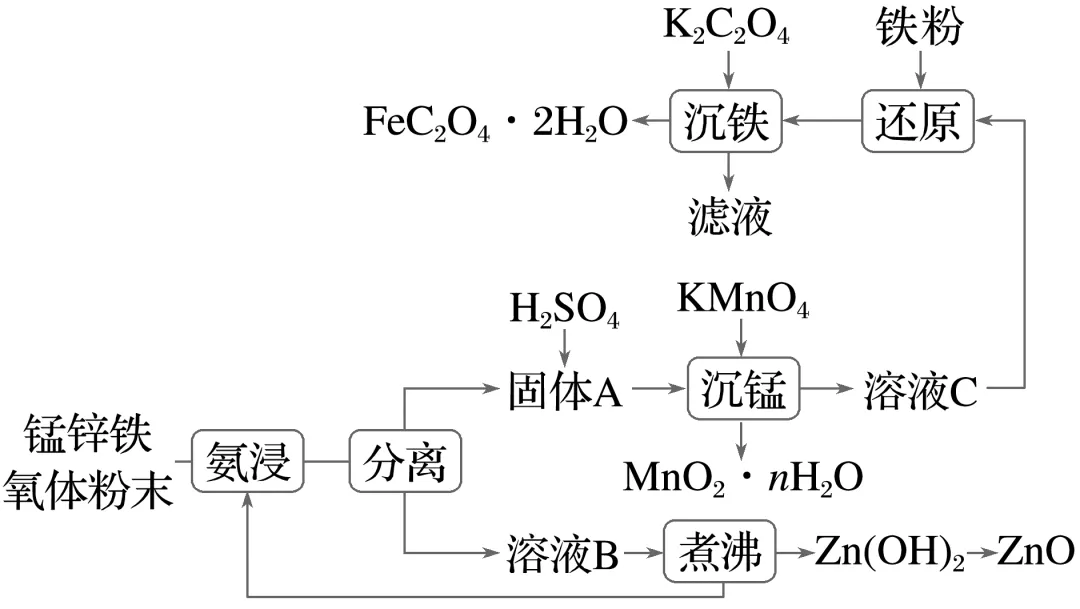
(1)氨浸的作用是将元素(填元素符号)有效转移到水溶液中。
(2)煮沸含有配合物的溶液B,产生混合气体,经冷凝后所得溶液可循环用于氨浸,该溶液是。
(3)沉锰反应的离子方程式为。
(5)通过加入CaSO4固体,除去滤液中危害环境的C2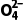 ,已知Ksp(CaSO4)=7.1×10-5,Ksp(CaC2O4)=2.3×10-9。反应CaSO4(s)+C2
,已知Ksp(CaSO4)=7.1×10-5,Ksp(CaC2O4)=2.3×10-9。反应CaSO4(s)+C2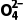 (aq)CaC2O4(s)
(aq)CaC2O4(s) (aq)的平衡常数为。
(aq)的平衡常数为。
答案 (1)Zn (2)氨水 (3)3Mn2+ +(5n+2)H2O5MnO2·nH2O↓+4H+ (5)3.1×104
+(5n+2)H2O5MnO2·nH2O↓+4H+ (5)3.1×104
解析锰锌铁氧体经过氨浸后,分离得到的溶液B经煮沸得到氢氧化锌,则氨浸的作用是将锌元素转移到溶液B中,将分离得到的固体A溶于硫酸,得到含锰、铁元素的溶液;沉锰过程中,KMnO4与Mn2+发生归中反应生成MnO2·nH2O;由于加入铁粉还原,则溶液C主要含三价铁离子,铁粉将铁离子还原为二价铁离子,加入K2C2O4沉铁,将二价铁离子转化为FeC2O4·2H2O。
(5)平衡常数K=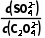 =
=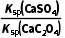 =
=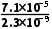 ≈3.1×104。
≈3.1×104。
[模拟演练]
4.(16分)(1)在1.0 L Na2CO3溶液中溶解0.01 mol BaSO4,则Na2CO3溶液的最初浓度不得低于 mol·L-1(忽略溶液体积变化)[已知:常温下Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9]。
(2)已知25 ℃时CH3COONH4呈中性,则该温度下CH3COONH4溶液中水电离的H+浓度为,
溶液中离子浓度大小关系为。
(3)NH4Cl溶液呈(填“酸”“碱”或“中”)性,其原因是(用离子方程式表示)。
NaHCO3溶液呈(填“酸”“碱”或“中”)性,其原因是(用离子方程式表示)。
(4)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是。(已知lg 2=0.3,离子浓度低于10-5mol·L-1时认为沉淀完全)
答案 (1)0.11 (2)1.0×10-7 mol·L-1
c(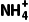 )=c(CH3COO-)>c(OH-)=c(H+)
)=c(CH3COO-)>c(OH-)=c(H+)
(3)酸 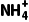 +H2ONH3·H2O+H+ 碱
+H2ONH3·H2O+H+ 碱  +H2OH2CO3+OH- (4)3.3≤pH<9
+H2OH2CO3+OH- (4)3.3≤pH<9
解析(1)沉淀转化的离子方程式为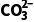 (aq)+BaSO4(s)
(aq)+BaSO4(s) 3(s)+
3(s)+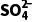 (aq),K=
(aq),K=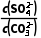 =
=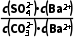 =
=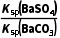 =
=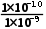 =0.1,c(
=0.1,c(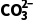 )=
)=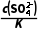 =
=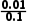 mol·L-1=0.1mol·L-1,Na2CO3溶液的最初浓度c(Na2CO3)≥(0.01+0.1)mol·L-1=0.11mol·L-1。(2)CH3COOH和NH3·H2O的电离常数相等,则该温度下CH3COONH4溶液中铵根离子和醋酸根离子水解程度相同,导致醋酸铵溶液呈中性;水电离出氢离子的浓度为1.0×10-7mol·L-1;水的电离程度很小,溶液中离子浓度大小顺序是c(
mol·L-1=0.1mol·L-1,Na2CO3溶液的最初浓度c(Na2CO3)≥(0.01+0.1)mol·L-1=0.11mol·L-1。(2)CH3COOH和NH3·H2O的电离常数相等,则该温度下CH3COONH4溶液中铵根离子和醋酸根离子水解程度相同,导致醋酸铵溶液呈中性;水电离出氢离子的浓度为1.0×10-7mol·L-1;水的电离程度很小,溶液中离子浓度大小顺序是c(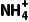 )=c(CH3COO-)>c(OH-)=c(H+)。
)=c(CH3COO-)>c(OH-)=c(H+)。
(4)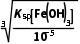 ≤c(OH-)<
≤c(OH-)<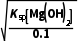 ,即
,即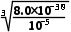 mol·L-1≤c(OH-)<
mol·L-1≤c(OH-)< mol·L-1,2×10-11mol·L-1≤c(OH-)<1×10-5mol·L-1,mol·L-1<c(H+)≤
mol·L-1,2×10-11mol·L-1≤c(OH-)<1×10-5mol·L-1,mol·L-1<c(H+)≤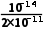 mol·L-1,则3.3≤pH<9。
mol·L-1,则3.3≤pH<9。
5.(3分)某小组用工业废铜焙烧得到的CuO(杂质为氧化铁及泥沙)为原料制备胆矾(CuSO4·5H2O)。将CuO加入适量的稀硫酸中,加热。待CuO完全反应后停止加热,边搅拌边加入适量H2O2,冷却后用NH3·H2O调节pH为3.5~4,再煮沸10 min,冷却后过滤。用NH3·H2O调节pH为3.5~4的目的是
。
答案 促使F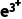 水解生成Fe(OH)3沉淀,同时防止Cu2+水解生成Cu(OH)2沉淀
水解生成Fe(OH)3沉淀,同时防止Cu2+水解生成Cu(OH)2沉淀
解析 CuO为碱性氧化物,与硫酸发生复分解反应:CuO+H2SO4===CuSO4+H2O,除此之外,由于混有氧化铁,溶于硫酸产生Fe3+,Fe3+与Cu发生反应生成Fe2+和Cu2+,依据流程可知,加入过氧化氢,重新氧化亚铁离子,便于后续除杂,控制溶液pH为3.5~4的目的是使Fe3+沉淀析出,同时防止Cu2+水解生成Cu(OH)2沉淀,导致产品不纯。
6.(5分)捕获CO2有助于实现碳中和。海洋是地球上最大的“碳库”,海水中存在的主要碳平衡关系如图所示。
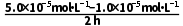
已知:①Ka1(H2CO3)=10-6.37,Ka2(H2CO3)=10-10.33;Ksp(CaCO3)=10-8.35。
②25 ℃时,海水的pH≈8,表层海水中c(H2CO3)=10-4.97 mol·L-1。
(1)25 ℃时,表层海水中浓度最大的含碳微粒为(填“H2CO3”“ ”或“
”或“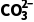 ”)。
”)。
(2)海洋中形成珊瑚礁(主要成分为CaCO3)可能涉及反应:Ca2+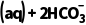 (aq)CaCO3(s)+H2CO3(aq)。请从化学平衡的角度,通过计算判断该反应进行的趋势大小:
(aq)CaCO3(s)+H2CO3(aq)。请从化学平衡的角度,通过计算判断该反应进行的趋势大小:
(平衡常数可反映反应的趋势。一般认为K>105时,反应基本能完全进行;K<10-5时,则反应很难进行)。
答案 (1)
(2)K=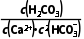 =
=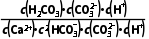 =
=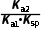 =104.39,K值已经很接近105,该反应进行的趋势很大
=104.39,K值已经很接近105,该反应进行的趋势很大
解析Ka1=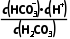 =
=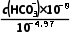 =10-6.37,得c(HC
=10-6.37,得c(HC )=10-3.34mol·L-1,则表层海水中浓度最大的含碳微粒为HC
)=10-3.34mol·L-1,则表层海水中浓度最大的含碳微粒为HC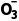 。
。
7.(8分)(2025·河南二模)草酸钴在化学中应用广泛,可用于制备催化剂等。以钴矿[主要成分为CoO、Co2O3、Co(OH)2,含少量的SiO2、Al2O3、FeO、MnO2等]为原料制取草酸钴晶体(CoC2O4·2H2O)的工艺流程如图所示。
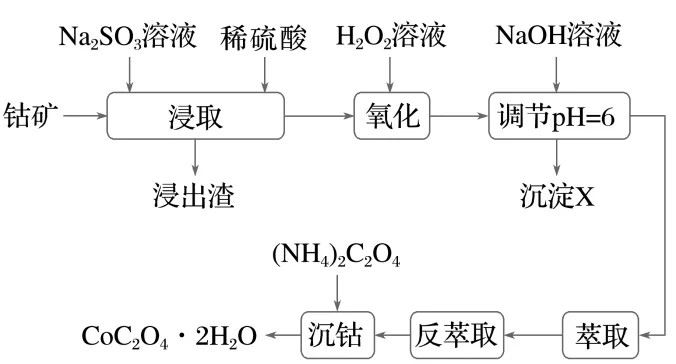
已知:溶液中相关离子沉淀完全(c≤1.0×10-5 mol·L-1)时的pH:
沉淀 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
完全沉淀的pH | 2.8 | 5.2 | 10.1 | 9.4 |
(1)“浸取”时Co2O3发生反应的离子方程式为。
(2)“氧化”过程中消耗H2O2的量明显偏高的原因是(用化学方程式表示)。
(3)在“调节pH=6”的步骤中,沉淀X的成分为。
(4)在“萃取”步骤中,向溶液中加入某有机酸萃取剂(HA)2,发生反应:Co2++n(HA)2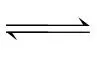 2·(n-1)(HA)2+2H+。当溶液pH处于一定范围内时,测得Co2+萃取率随溶液pH的增大而增大,其原因是。
2·(n-1)(HA)2+2H+。当溶液pH处于一定范围内时,测得Co2+萃取率随溶液pH的增大而增大,其原因是。
答案 (1)Co2O3+S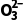 +4H+===2Co2++2H2O+S
+4H+===2Co2++2H2O+S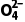 (2)2H2O2
(2)2H2O2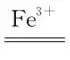 2O+O2↑
2O+O2↑
(3)Fe(OH)3、Al(OH)3
(4)随着溶液的pH增大,c(H+)减小,萃取反应平衡向正反应方向移动

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享