n
五、化学反应的方向 速率与平衡
(一)化学反应的方向
复合判据
ΔG=ΔH-TΔS
注意(1)ΔH<0,ΔS>0的反应任何温度下都能自发进行。
(2)ΔH>0,ΔS<0的反应任何温度下都不能自发进行。
(3)当ΔH<0,ΔS<0时,低温下反应能自发进行;当ΔH>0,ΔS>0时,高温下反应能自发进行。
 易错辨析
易错辨析
(1)在常温下,放热反应一般能自发进行,吸热反应都不能自发进行( )
(2)在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向 ( )
(3)ΔH<0,ΔS>0时,反应自发进行,如金属钠和水的反应( )
(4)一定温度下,反应2H2(g)+O2(g)===2H2O(g)能自发进行,该反应ΔH<0( )
(5)反应4Fe(s)+3O2(g)===2Fe2O3(s)常温下可自发进行,该反应为吸热反应( )
(6)反应N2(g)+3H2(g)2NH3(g)的ΔH<0,ΔS>0( )
(7)常温下,反应C(s)+CO2(g)2CO(g)不能自发进行,则该反应的ΔH<0( )
答案 (1)× (2)× (3)√ (4)√ (5)× (6)× (7)×
解析(1)反应是否能自发,必须综合考虑反应体系的焓变和熵变。依据ΔG=ΔH-TΔS分析,ΔG<0时可自发,当ΔH>0,ΔS>0时,只要熵增较大,常温下可以有ΔG<0,如Ba(OH)2·8H2O与NH4Cl的反应虽然是吸热反应,但常温下也可以自发进行。
(2)催化剂只能降低反应的活化能,加快反应速率,不能改变化学反应进行的方向。
(3)金属钠和水反应生成氢气并大量放热,ΔH<0,ΔS>0,所以ΔG=ΔH-TΔS<0,该反应在任何温度下都能自发进行。
(4)、(5)反应后气体分子数均减少,都是熵减反应(ΔS<0),且在一定温度下均能自发进行,根据ΔG=ΔH-TΔS<0反应能自发进行,可知这两个反应均属于放热反应(ΔH<0)。
(6)反应后气体分子数减少,ΔS<0。
(7)反应为气体分子数增加的熵增反应(ΔS>0),常温下不能自发进行,则该反应ΔH>0。
(二)化学反应速率及影响因素
1.速率(公式法,v=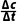 =
=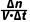 ;比例法,找变化的数据之比)、瞬时速率(切线交点)的计算。
;比例法,找变化的数据之比)、瞬时速率(切线交点)的计算。
2.化学反应速率的影响(①浓度——固体或纯液体不作考虑;②温度——注意受热易分解或易挥发物质对速率的影响;③压强——注意反应体系内各气态物质浓度是否变化;④催化剂——注意催化剂活性与温度的关系,一定温度下,催化剂的活性最高,温度过高会失去活性;⑤原电池;⑥接触面积。最有效的手段是使用催化剂,其次是温度。关注矛盾的主要方面:哪个影响更大?)
 易错辨析
易错辨析
(1)增大反应物的浓度,能够增大活化分子的百分含量,所以反应速率增大( )
(2)增大反应体系的压强,反应速率不一定增大( )
(3)恒压容器中发生反应N2+O2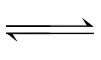
(4)10.0 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变( )
(5)已知t1 ℃时,反应C+CO2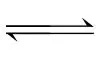 H>0的速率为v,若升高温度,逆反应速率减小( )
H>0的速率为v,若升高温度,逆反应速率减小( )
(6)CuCl(s)+2Cl-(aq)[CuCl3]2-(aq),其他条件相同,增大CuCl的量,可加快生成[CuCl3]2-的速率( )
(7)催化剂能影响活化能,进而影响ΔH( )
(8)决速步骤反应是活化能最低,反应最快的基元反应( )
(9)中间产物就是过渡态( )
(10)为了加快锌和稀硫酸生成氢气的速率,可以滴加几滴硫酸铜溶液( )
(11)升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数( )
(12)催化剂能降低反应的活化能,提高活化分子百分数,增大反应速率( )
答案 (1)× (2)√ (3)× (4)× (5)× (6)× (7)× (8)× (9)× (10)√ (11)√ (12)√
(三)化学平衡及平衡移动
1.化学平衡状态
(1)定义:在一定条件下,可逆反应的正反应速率等于逆反应速率,体系中各成分的浓度(或百分含量)保持不变的状态称为化学平衡状态,简称化学平衡。
(2)特征及其意义
特征 | 意义 |
逆 | 化学平衡的研究对象是可逆反应 |
等 | 平衡后v正=v逆,这是平衡的本质 |
动 | 化学平衡是动态平衡,即v正=v逆≠0 |
定 | 体系中各成分的浓度和百分含量保持“定值”,这是平衡的现象 |
变 | 条件改变,平衡可能会移动 |
2.化学平衡常数及影响因素
(1)化学平衡常数的表达式及大小与化学方程式的书写有关。
例如:N2(g)+3H2(g)2NH3(g) K1=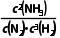 ,则
,则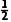 N2(g) +
N2(g) + 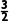 H2(g)NH3(g) K2=
H2(g)NH3(g) K2=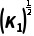 或
或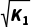 (用K1表示,下同);2NH3(g)N2(g)+3H2(g) K3=
(用K1表示,下同);2NH3(g)N2(g)+3H2(g) K3=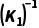 或
或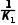 。
。
(2)平衡常数K与温度的关系
温度变化 | 可逆反应的ΔH | K的变化 |
升温 | 吸热反应,ΔH>0 | 增大 |
降温 | 减小 |
升温 | 放热反应,ΔH<0 | 减小 |
降温 | 增大 |
(3)平衡常数K与浓度商Q的关系
达到平衡状态,Q=K;
平衡正向移动,Q<K;
平衡逆向移动,Q>K。
3.影响化学平衡移动的因素(假设研究对象均为基元反应)
条件的改变 | 瞬间速率的变化和相对大小 | 平衡移动的方向 |
浓度 | 增大c反 | 瞬间v正增大,v逆不变,v正>v逆 | 正移(右移) |
增大c产 | 瞬间v正不变,v逆增大,v正<v逆 | 逆移(左移) |
压强 | 反应前后气体计量数之和不同 | 加压 | 瞬间v正、v逆均增大,计量数之和大的v增大幅度更大 | 往气体减少方向移动 |
减压 | 瞬间v正、v逆均减小,计量数之和大的v减小幅度更大 | 往气体增多方向移动 |
温度 | 升高温度 | 瞬间v正、v逆均增大,吸热反应方向v增大幅度更大 | 往吸热反应方向移动 |
降低温度 | 瞬间v正、v逆均减小,吸热反应方向v减小幅度更大 | 往放热反应方向移动 |
注:催化剂同等程度影响v正、v逆,加催化剂后,v正=v逆,平衡不移动,但催化剂可以缩短达到平衡的时间 |
| | | | |
4.外因对化学平衡的影响及实验探究
(1)浓度对化学平衡的影响
已知:在K2Cr2O7溶液中存在以下平衡:
Cr2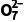 (橙色)+H2O2Cr
(橙色)+H2O2Cr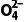 (黄色)+2H+
(黄色)+2H+
取一支试管,加入2 mL 0.1 mol·L-1 K2Cr2O7溶液,然后按下表步骤进行实验,观察溶液颜色的变化,判断平衡是否发生移动及移动的方向。完成下表:
实验步骤 | 实验现象 | 结论 |
①向试管中滴加5~10滴 6 mol·L-1 NaOH溶液 | 溶液变为黄色 | 在其他条件不变时,减小生成物的浓度,平衡正向移动 |
②向试管中继续滴加5~10滴6 mol·L-1 H2SO4溶液 | 溶液变为橙色 | 在其他条件不变时,增大生成物的浓度,平衡逆向移动 |
(2)温度对化学平衡的影响
在CuCl2溶液中存在以下平衡:
[Cu(H2O)4]2+(蓝色)+4Cl-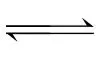 4]2-(黄色)+4H2O ΔH>0
4]2-(黄色)+4H2O ΔH>0
分别取2 mL 0.5 mol·L-1 CuCl2溶液加入两支试管中,将其中的一支试管先加热,然后置于冷水中,观察并记录实验现象,与另一支试管进行对比。完成下表:
实验步骤 | 实验现象 | 结论 |
①加热试管 | 溶液变为黄绿色 | 在其他条件不变时,升高温度,平衡向吸热反应方向移动 |
②将上述试管置于冷水中 | 溶液由黄绿色变为蓝绿色 | 在其他条件不变时,降低温度,平衡向放热反应方向移动 |
5.多平衡体系中图像问题
(1)化学平衡数据、图像信息应用(有哪些变量?怎么变?为什么这么变?注意特殊的点或曲线)。
(2)物质选择性变化
①怎么变?条件变化→移动方向→移动结果;
②和为1的,知一个找另外一个;
③多个反应中使用高效催化剂能改变物质的选择性,大幅度提高目标产物在最终产物中的比例。
 自我检测
自我检测
1.化学平衡常数基本常识判断
(1)平衡正向移动,K增大;平衡逆向移动,K减小( )
(2)同一反应的K改变,温度一定改变,平衡一定移动( )
(3)温度一定,对于给定的化学反应,正、逆反应的平衡常数互为倒数( )
(4)平衡常数表达式中不可能有水的浓度( )
答案 (1)× (2)√ (3)√ (4)×
解析(1)K只受温度的影响。平衡的移动可能是温度改变引起的,这种改变会影响K值;但也可能是浓度或者压强改变引起的,这种改变不会影响K值。
(2)K改变则温度一定改变。 由于温度对v正、v逆影响程度不一样,温度改变平衡一定移动。
(3)温度一定时,对于确定的化学反应,其化学平衡常数不变。对于给定的化学反应,由于正反应、逆反应的反应物与生成物相反,则正、逆反应的平衡常数互为倒数。
(4)若反应中的水是气态可以写入平衡常数表达式。
2.基本理论的理解与辨析

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享