n
第2练 大学教材衔接类试题
[分值:100分]
(1~7题,每小题4分,8~12题,每小题6分)
1.已知电对的标准电极电势(Eθ)越高,其中氧化剂的氧化性越强。现有4组电对的标准电极电势:①PbO2/PbSO4,Eθ=1.68 V;②Mn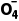 /Mn2+,Eθ=1.51 V;③Fe3+/Fe2+,Eθ=0.77 V;④Cl2/Cl-,Eθ=1.36 V。下列有关说法正确的是( )
/Mn2+,Eθ=1.51 V;③Fe3+/Fe2+,Eθ=0.77 V;④Cl2/Cl-,Eθ=1.36 V。下列有关说法正确的是( )
A.Cl2可与Fe2+发生反应:2Fe2++Cl2===2Fe3++2Cl-
B.酸化高锰酸钾时既可以用硫酸也可以用盐酸
C.向含2 mol FeCl2的溶液中加入1 mol PbO2可观察到黄绿色气体
D.PbO2与酸性MnSO4反应的离子方程式:5PbO2+2Mn2++2H2O+5S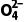 ===5PbSO4+2Mn
===5PbSO4+2Mn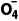 +4OH-
+4OH-
答案 A
解析由电对的标准电极电势越高,其中氧化剂的氧化性越强可知,氧化剂的氧化性由强到弱的顺序为PbO2>Mn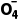 >Cl2>Fe3+。Cl2的氧化性强于Fe3+,Cl2能与Fe2+反应生成Fe3+,反应的离子方程式为2Fe2++ Cl2===2Fe3++2Cl-,故A正确;Mn
>Cl2>Fe3+。Cl2的氧化性强于Fe3+,Cl2能与Fe2+反应生成Fe3+,反应的离子方程式为2Fe2++ Cl2===2Fe3++2Cl-,故A正确;Mn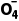 的氧化性强于Cl2,Mn
的氧化性强于Cl2,Mn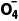 能与盐酸发生氧化还原反应生成Cl2,则酸化高锰酸钾时不能用盐酸,故B错误;由A项知还原性:Fe2+>Cl-,还原性更强的Fe2+先与PbO2反应,根据FeCl2与PbO2的量可知不可能有黄绿色气体生成,故C错误;PbO2的氧化性强于Mn
能与盐酸发生氧化还原反应生成Cl2,则酸化高锰酸钾时不能用盐酸,故B错误;由A项知还原性:Fe2+>Cl-,还原性更强的Fe2+先与PbO2反应,根据FeCl2与PbO2的量可知不可能有黄绿色气体生成,故C错误;PbO2的氧化性强于Mn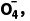 PbO2能将Mn2+氧化成Mn
PbO2能将Mn2+氧化成Mn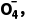 自身转化为PbSO4沉淀,反应的离子方程式为5PbO2+2Mn2++5S
自身转化为PbSO4沉淀,反应的离子方程式为5PbO2+2Mn2++5S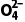 +4H+===5PbSO4+ 2Mn
+4H+===5PbSO4+ 2Mn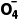 +2H2O,故D错误。
+2H2O,故D错误。
2.甲醇制丙烯的反应为3CH3OH(g)C3H6(g)+3H2O(g) ΔH,已知:速率常数k与反应温度T、活化能Ea之间满足关系:Rlg k=-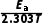 +Rlg A(R和A为常数)。下列说法错误的是( )
+Rlg A(R和A为常数)。下列说法错误的是( )
A.加催化剂不能减小ΔH
B.升温能改变该反应的速率常数k
C.已知CH3OH、C3H6的燃烧热可以计算该反应的ΔH
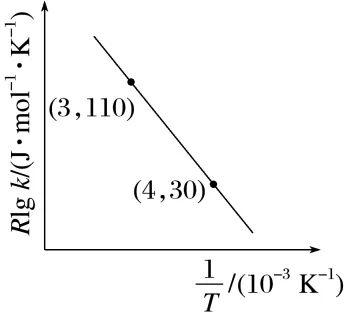
D.若实验得出Rlg k和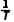 的关系如图,可计算得到该反应的活化能Ea为184.24 kJ·mol-1
的关系如图,可计算得到该反应的活化能Ea为184.24 kJ·mol-1
答案 C
解析加催化剂能减小活化能,加快反应速率,但是不改变焓变,A正确;根据信息可知,速率常数k只与Ea和T有关,则升温能改变该反应的速率常数k,B正确;燃烧热定义中的水为液态,而该方程式中水为气态,不能用燃烧热计算,C错误;由图结合题意可知,Ea=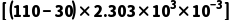 kJ·mol-1=184.24kJ·mol-1,D正确。
kJ·mol-1=184.24kJ·mol-1,D正确。
3.(2025·山东泰安模拟预测)氯苯在液氨溶液中可以与氨基钠反应生成苯胺。某研究小组提出了三种可能的机理:
机理1:
机理2:
机理3:
以下事实能同时排除“机理1”和“机理2”的是( )
A.增加NaNH2浓度,反应速率明显变快
B.存在带负电荷的中间体
C.可以发生反应:
D.C6H5X的反应活性:Br>I>Cl>F
答案 D
解析若反应为“机理1”,则第一步为决速步,增加NaNH2浓度,反应速率变快,符合事实,不能排除该机理;若反应为“机理2”,则第一步为决速步,增加NaNH2浓度,反应速率几乎不变,不符合事实,能排除该机理,A不符合题意;若反应为“机理1”,则中间体1带负电荷,符合事实,不能排除该机理;若反应为“机理2”,则中间体2带正电荷,不符合事实,能排除该机理,B不符合题意;若反应为“机理1”,则可以发生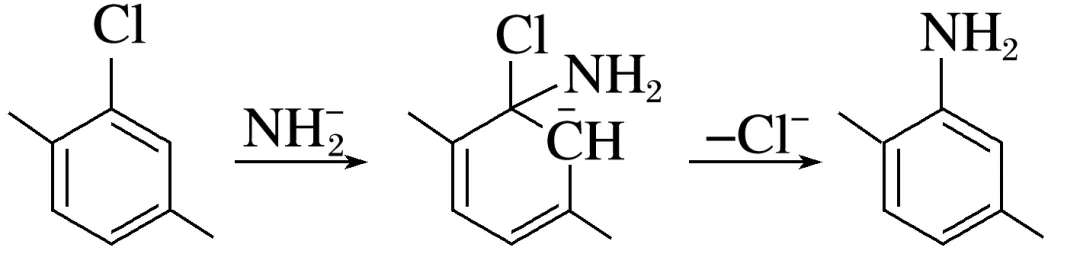 ,不能排除该机理;若反应为“机理2”,则可以发生
,不能排除该机理;若反应为“机理2”,则可以发生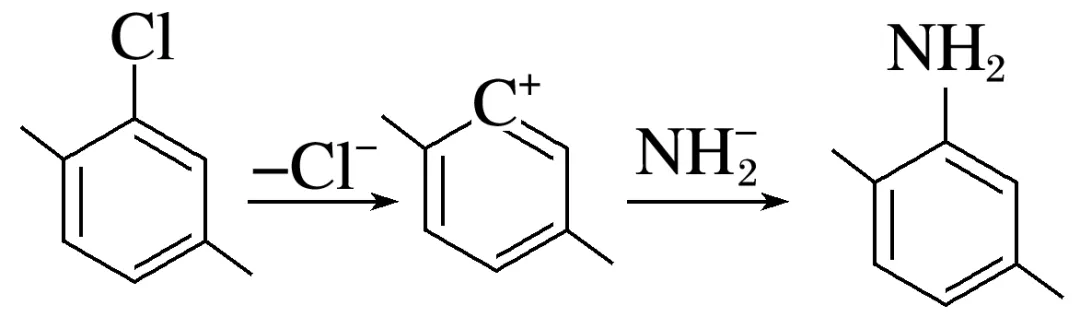 ,不能排除该机理,C不符合题意;
,不能排除该机理,C不符合题意;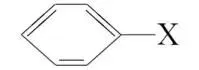 的反应活性:Br>I>Cl>F,中C—Cl和苯环很难被破坏,“机理1”中的第一步和“机理2”中的第一步很难发生,能够同时排除“机理1”和“机理2”,D符合题意。
的反应活性:Br>I>Cl>F,中C—Cl和苯环很难被破坏,“机理1”中的第一步和“机理2”中的第一步很难发生,能够同时排除“机理1”和“机理2”,D符合题意。
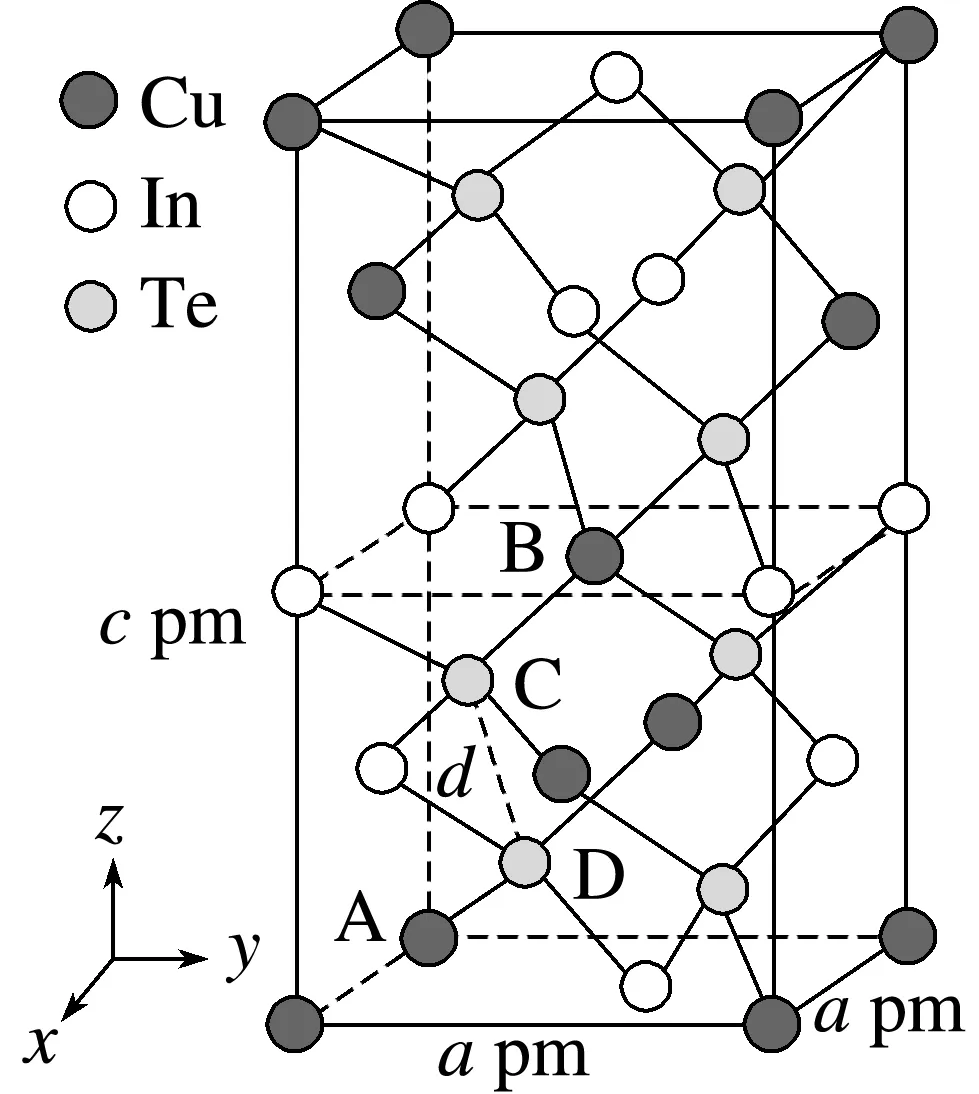
4.(2025·河南部分名校联考模拟)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,A点、B点原子的分数坐标分别为(0,0,0)、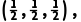 设NA为阿伏加德罗常数的值,下列说法错误的是( )
设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.该晶体的化学式为CuInTe2
B.D点原子的分数坐标为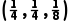
C.该晶体的摩尔体积为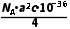 m3·mol-1
m3·mol-1
D.晶胞中A、D间距离为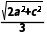 pm
pm
答案 D
解析晶胞中位于顶角、面上和体内的铜原子个数为8×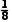 +4×
+4×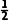 +1=4,位于面上、棱上的In原子个数为6×
+1=4,位于面上、棱上的In原子个数为6×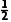 +4×
+4×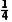 =4,位于体内的Te原子个数为8×1=8,所以该晶体的化学式为CuInTe2,故A正确;由A点和B点原子的分数坐标可知,D点原子的分数坐标为
=4,位于体内的Te原子个数为8×1=8,所以该晶体的化学式为CuInTe2,故A正确;由A点和B点原子的分数坐标可知,D点原子的分数坐标为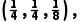 故B正确;晶胞中含4个Cu、4个In、8个Te,该晶体的摩尔体积为
故B正确;晶胞中含4个Cu、4个In、8个Te,该晶体的摩尔体积为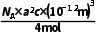 =
=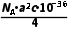 m3·mol-1,故C正确;A点原子的分数坐标为(0,0,0),D点原子的分数坐标为
m3·mol-1,故C正确;A点原子的分数坐标为(0,0,0),D点原子的分数坐标为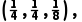 则晶胞中A、D间距离为
则晶胞中A、D间距离为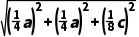 pm=
pm= 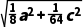 pm,故D错误。
pm,故D错误。
5.(2025·湖南,14)环氧化合物是重要的有机合成中间体,以钛掺杂沸石为催化剂,由丙烯()为原料生产环氧丙烷()的反应机理如图所示。下列说法正确的是( )
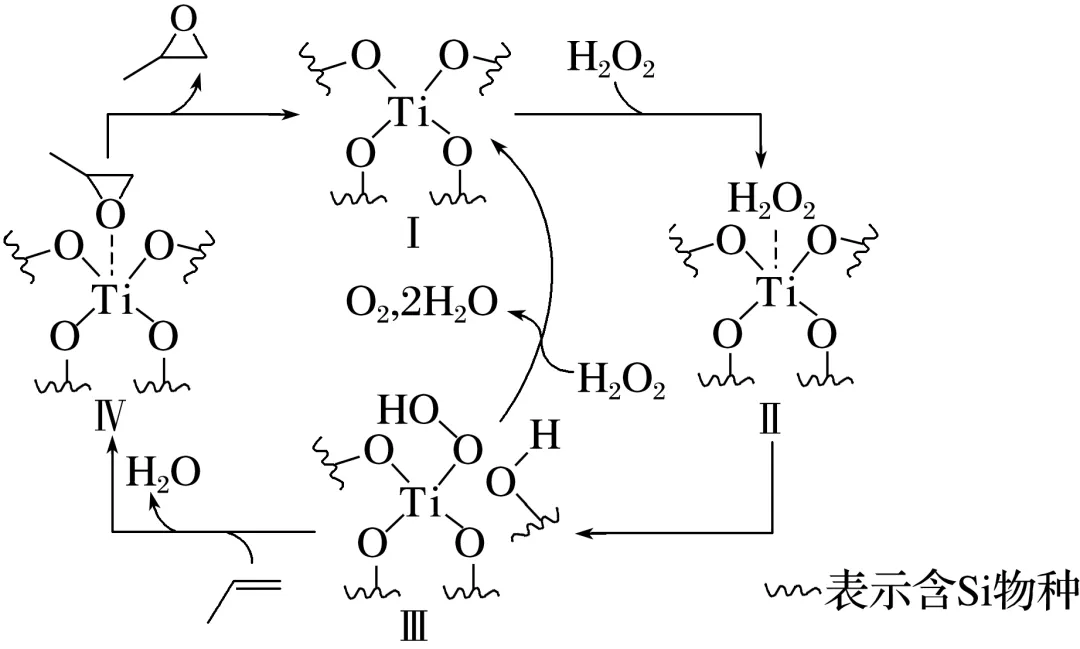
A.过程中Ⅱ是催化剂
B.过程中有极性键和非极性键的断裂和形成
C.过程中Ti元素的化合价发生了变化
D.丙烯与双氧水反应生成环氧丙烷的原子利用率为100 %
答案 B
解析根据反应原理,Ⅰ先消耗,再生成,是整个历程的催化剂,Ⅱ先生成,再消耗,是中间产物,A错误;过程中存在H2O2中O—O非极性键的断裂,以及O2中非极性键的形成,还存在O—H极性键的断裂,以及O—C极性键的形成,B正确;过程中Ti的化学键(Ti—O)始终是4个,配位键不会改变Ti的化合价,故Ti元素的化合价不变,C错误;反应生成了H2O,且存在H2O2的分解反应,原子利用率小于100%,D错误。
6.(2025·河南商丘模拟)丁二酮肟常用于检验废水中的Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,该沉淀的结构如图所示。下列对该鲜红色沉淀的说法错误的是( )
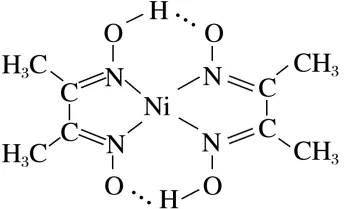
A.该物质中存在极性共价键和非极性共价键
B.基态Ni2+的价层电子排布式为3d8
C.Ni2+的配位原子是N,配位数是4
D.基态C、O原子的未成对电子数不相同
答案 D
解析该物质中存在碳氢、碳氮、氮氧等极性共价键和碳碳非极性共价键,A正确;镍为28号元素,镍原子失去2个电子形成镍离子,基态Ni2+的价层电子排布式为3d8,B正确;Ni2+与4个N形成配位键,Ni2+的配位数为4,C正确;基态C、O原子的核外电子排布式分别为1s22s22p2、1s22s22p4,未成对电子数均为2个,D错误。
7.(2025·河南商丘模拟)苯与浓硝酸、浓硫酸的混合物在60 ℃下的反应机理如图所示,资料显示:浓硝酸、浓硫酸混合时存在HONO2+H2SO4 3SO-+H2
3SO-+H2 、H2
、H2
 2O+
2O+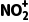 。下列说法错误的是( )
。下列说法错误的是( )
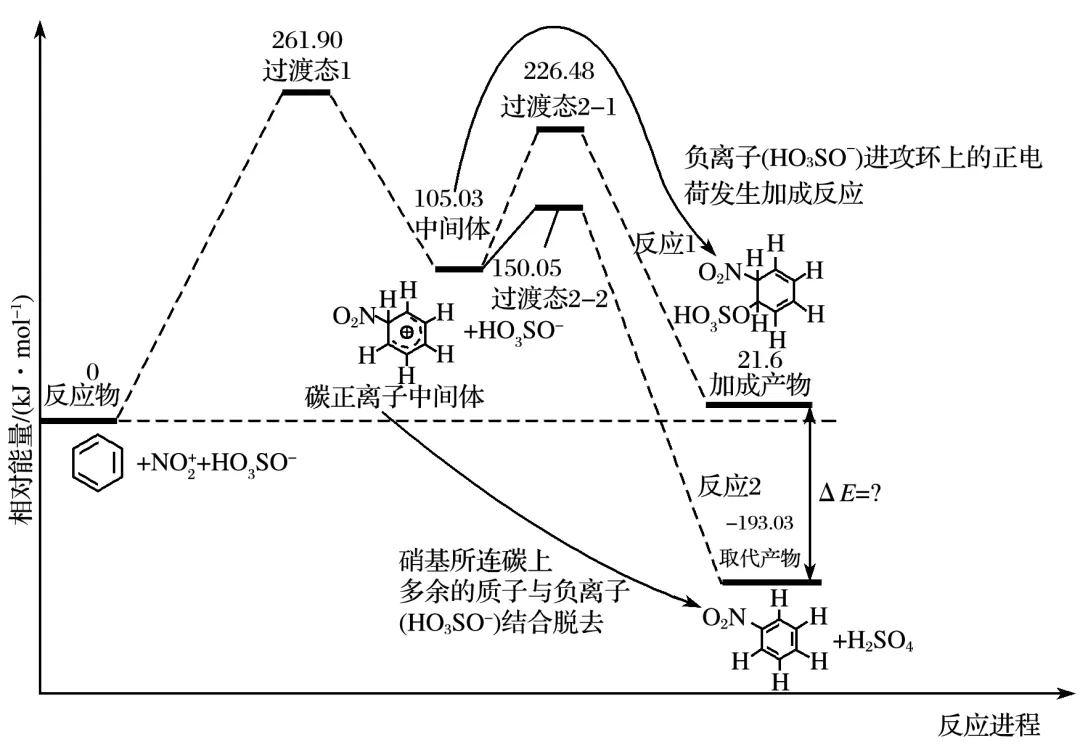
A.H2O的空间结构为V形
B.从结构上看,碳正离子中间体和取代产物中所有原子都不可能处于同一平面
C.反应1的反应速率比反应2的反应速率慢
D.从能量变化上看,取代产物与加成产物的能量差值ΔE=214.63 kJ·mol-1,取代产物更稳定
答案 B
解析碳正离子中间体存在sp3杂化,所有原子不可能共平面,而取代产物中C、N、O原子均为sp2杂化,所有原子可能共平面,B项错误;反应1从中间体到过渡态的活化能较高,所以反应1的反应速率比反应2的反应速率慢,C项正确;从能量变化上看,取代产物与加成产物的能量差值ΔE=214.63kJ·mol-1,能量越低越稳定,所以取代产物更稳定,D项正确。
8.(2025·青岛一模)工业合成尿素:HNCO(g)+NH3(g)CO(NH2)2(g) ΔH<0。恒容密闭容器中加入等物质的量的HNCO和NH3,在T1 ℃和T2 ℃反应均达到平衡,lg p(NH3)与lg p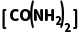 关系如图所示(压强单位均为kPa)。反应dD(g)+eE(g)gG(g)的标准平衡常数Kθ=
关系如图所示(压强单位均为kPa)。反应dD(g)+eE(g)gG(g)的标准平衡常数Kθ=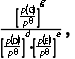 pθ=100 kPa。下列说法错误的是( )
pθ=100 kPa。下列说法错误的是( )
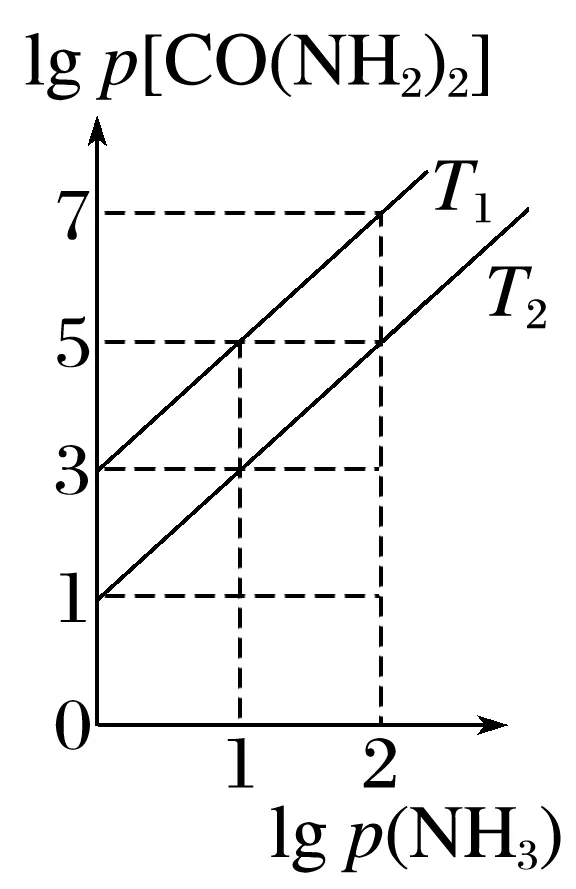
A.T1<T2
B.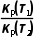 =
=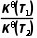
C.T2 ℃下,平衡时体系的总压强为250 kPa时,p(NH3)≈4.9 kPa
D.若改为恒压密闭容器,则平衡时CO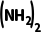 的体积分数减小
的体积分数减小
答案 D
解析由图知,lgp(NH3)相同时,T2℃时的lgp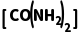 小于T1℃时的lgp
小于T1℃时的lgp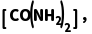 说明温度由T1℃到T2℃时,平衡逆向移动,该反应是放热反应,则T1<T2,故A正确;Kθ=
说明温度由T1℃到T2℃时,平衡逆向移动,该反应是放热反应,则T1<T2,故A正确;Kθ=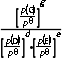 =
=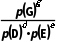 ×(pθ)d+e-g=Kp(pθ)d+e-g,则Kθ(T1)=Kp(T1)·(pθ)d+e-g,Kθ(T2)=Kp(T2)·(pθ)d+e-g,故
×(pθ)d+e-g=Kp(pθ)d+e-g,则Kθ(T1)=Kp(T1)·(pθ)d+e-g,Kθ(T2)=Kp(T2)·(pθ)d+e-g,故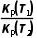 =
=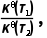 故B正确;T2℃时,lgp(NH3)=1,lgp
故B正确;T2℃时,lgp(NH3)=1,lgp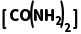 =3,则p(NH3)=10,p(HNCO)=10,p[CO
=3,则p(NH3)=10,p(HNCO)=10,p[CO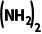 ]=1000,则Kp(T2)=
]=1000,则Kp(T2)=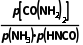 =
=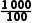 =10,若平衡时,p(NH3)≈4.9kPa,则Kp(T2)=
=10,若平衡时,p(NH3)≈4.9kPa,则Kp(T2)=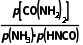 =
=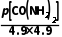 =10,则p[CO
=10,则p[CO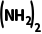 ]=240.1kPa,p总=p[CO
]=240.1kPa,p总=p[CO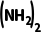 ]+p(NH3)+p(HNCO)≈250kPa,故C正确;反应HNCO(g)+NH3(g)
]+p(NH3)+p(HNCO)≈250kPa,故C正确;反应HNCO(g)+NH3(g)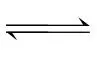
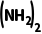 (g)是总物质的量减小的反应,若改为恒压密闭容器,相对于恒容密闭容器来说,相当于增大压强,平衡会正向移动,平衡时CO
(g)是总物质的量减小的反应,若改为恒压密闭容器,相对于恒容密闭容器来说,相当于增大压强,平衡会正向移动,平衡时CO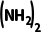 的体积分数会增大,故D错误。
的体积分数会增大,故D错误。
9.(2025·四川内江一模)《自然》杂志报道了一种充放电的铝离子电池,该电池的电解质为含有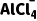 的离子
的离子

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享