n
第19练 化学反应速率 化学平衡移动与转化率图像
[分值:50分]
(1~4题,每小题5分,5~9题,每小题6分)
[真题专练]
1.(2025·安徽,11)恒温恒压密闭容器中,t=0时加入A(g),各组分物质的量分数x随反应时间t变化的曲线如图(反应速率v=kx,k为反应速率常数)。
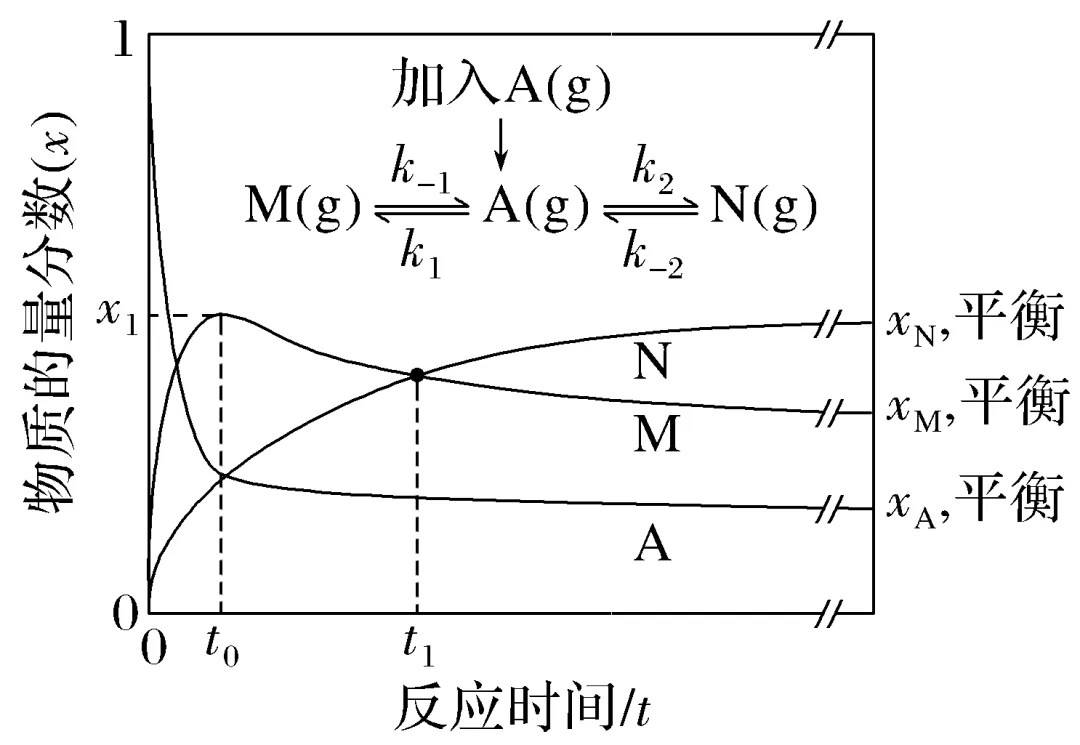
下列说法错误的是( )
A.该条件下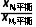 =
=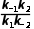
B.0~t1时间段,生成M和N的平均反应速率相等
C.若加入催化剂,k1增大,k2不变,则x1和xM,平衡均变大
D.若A(g)→M(g)和A(g)→N(g)均为放热反应,升高温度则xA,平衡变大
答案 C
解析反应达到平衡时,正、逆反应速率相等,则对于反应M(g)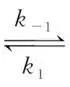 (g)存在关系式:k-1·xM,平衡=k1·xA,平衡,对于反应A(g)
(g)存在关系式:k-1·xM,平衡=k1·xA,平衡,对于反应A(g)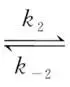 (g)存在关系式:k-2·xN,平衡=k2·xA,平衡,两式联立可得
(g)存在关系式:k-2·xN,平衡=k2·xA,平衡,两式联立可得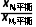 =
=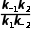 正确;起始时,xM和xN均为0,t1时,xM=xN,则0~t1时间段,生成M和N的平均反应速率相等,B正确;催化剂不影响平衡移动,故xM,平衡不变,C错误;A(g)→M(g)和A(g)→N(g)均为放热反应,则升高温度,平衡均逆向移动,故xA,平衡变大,D正确。
正确;起始时,xM和xN均为0,t1时,xM=xN,则0~t1时间段,生成M和N的平均反应速率相等,B正确;催化剂不影响平衡移动,故xM,平衡不变,C错误;A(g)→M(g)和A(g)→N(g)均为放热反应,则升高温度,平衡均逆向移动,故xA,平衡变大,D正确。
2.(2022·辽宁,12)某温度下,在1 L恒容密闭容器中,2.0 mol X发生反应2X(s)Y(g)+2Z(g),有关数据如下:
时间段/min | 产物Z的平均生成速率/(mol·L-1·min-1) |
0~2 | 0.20 |
0~4 | 0.15 |
0~6 | 0.10 |
下列说法错误的是( )
A.1 min时,Z的浓度大于0.20 mol·L-1
B.2 min时,加入0.20 mol Z,此时v正(Z)<v逆(Z)
C.3 min时,Y的体积分数约为33.3%
D.5 min时,X的物质的量为1.4 mol
答案 B
解析随着时间的延长,反应物浓度逐渐减小,产物Z的平均生成速率逐渐减小,则0~1min内Z的平均生成速率大于0~2min内的,故1min时,Z的浓度大于0.20mol·L-1,A正确;4min时生成的Z的物质的量为0.15mol·L-1·min-1×4min×1L=0.6mol,6min时生成的Z的物质的量为0.10mol·L-1·min-1×6min×1L=0.6mol,故反应在4min时已达到平衡,设达到平衡时生成了amolY,列三段式:
2X(s)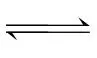 (g)+2Z(g)
(g)+2Z(g)
初始量/mol2.000
转化量/mol2aa2a
平衡量/mol2.0-2aa0.6
根据2a=0.6,得a=0.3,则Y的平衡浓度为0.3mol·L-1,Z的平衡浓度为0.6mol·L-1,平衡常数K=c2(Z)·c(Y)=0.108,2min时Y的浓度为0.2mol·L-1,Z的浓度为0.4mol·L-1,加入0.2molZ后,Z的浓度变为0.6mol·L-1,Q=c2(Z)·c(Y)=0.072<K,反应正向进行,故v正(Z)>v逆(Z),B错误;反应生成的Y与Z的物质的量之比恒等于1∶2,反应体系中只有Y和Z为气体,同温同压下,体积之比等于物质的量之比,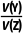 =
=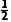 ,故Y的体积分数始终约为33.3%,C正确;由B项分析可知,5min时反应处于平衡状态,此时生成的Z为0.6mol,则X的转化量为0.6mol,初始X的物质的量为2.0mol,则剩余X的物质的量为1.4mol,D正确。
,故Y的体积分数始终约为33.3%,C正确;由B项分析可知,5min时反应处于平衡状态,此时生成的Z为0.6mol,则X的转化量为0.6mol,初始X的物质的量为2.0mol,则剩余X的物质的量为1.4mol,D正确。
3.(2024·重庆,14)醋酸甲酯制乙醇的反应为:CH3COOCH3(g)+2H2(g)CH3CH2OH(g)+CH3OH(g)。三个10 L恒容密闭容器中分别加入1 mol醋酸甲酯和9.8 mol氢气,在不同温度下,反应t分钟时醋酸甲酯物质的量n如图所示。下列说法正确的是( )
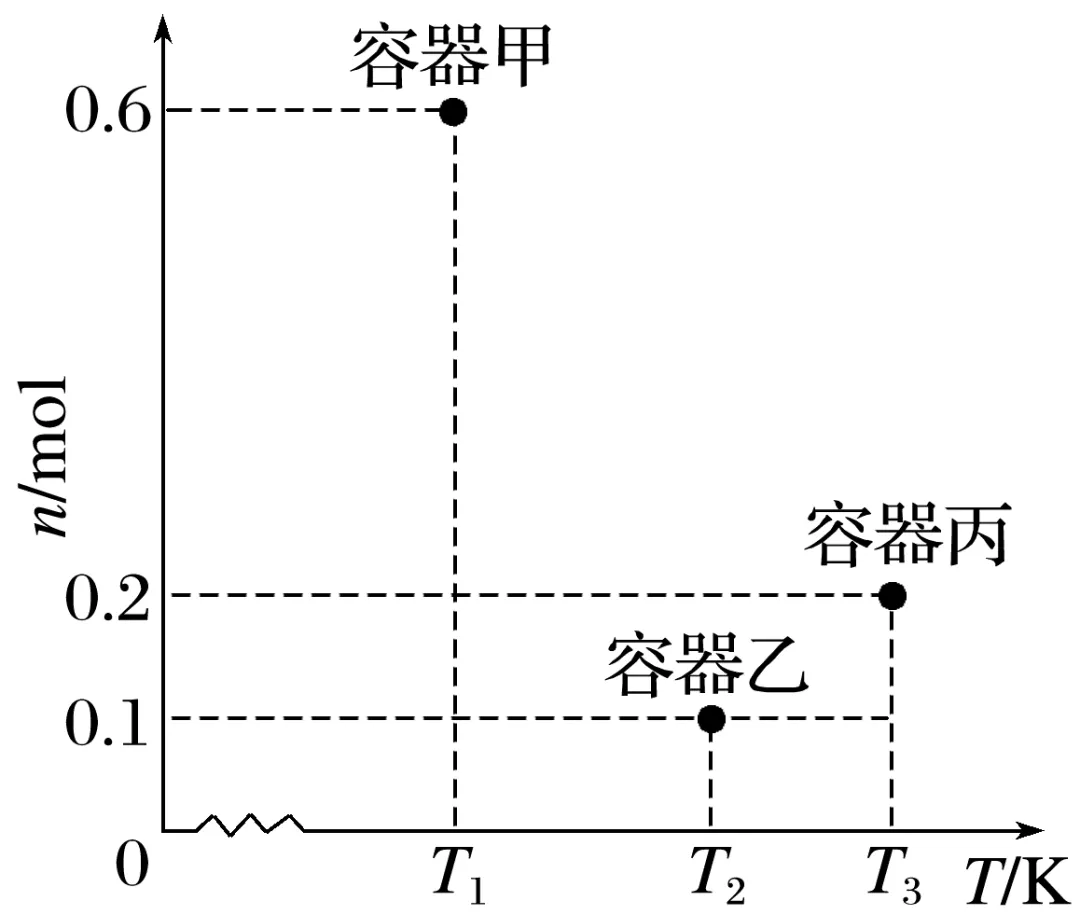
A.该反应的ΔH>0
B.容器甲中平均反应速率v(H2)=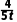 mol·L-1·min-1
mol·L-1·min-1
C.容器乙中当前状态下反应速率v正<v逆
D.容器丙中乙醇的体积分数为8%
答案 D
解析温度越高反应速率越快,比较乙、丙可知,丙反应升高温度,醋酸甲酯物质的量增大,则反应逆向进行,正反应为放热反应,ΔH<0,A错误;容器甲中平均反应速率v(H2)=2v(CH3COOCH3)=2×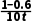 mol·L-1·min-1=
mol·L-1·min-1=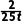 mol·L-1·min-1,B错误;温度越高反应速率越快,比较乙、丙可知,丙达到平衡状态,但不确定乙是否平衡,不能确定正逆反应速率相对大小,C错误;对丙而言:
mol·L-1·min-1,B错误;温度越高反应速率越快,比较乙、丙可知,丙达到平衡状态,但不确定乙是否平衡,不能确定正逆反应速率相对大小,C错误;对丙而言:
CH3COOCH3(g)+2H2(g) 3CH2OH(g)+CH3OH(g)
3CH2OH(g)+CH3OH(g)
起始/ (mol·L-1) 0.10.9800
转化/ (mol·L-1) 0.080.160.080.08
平衡/ (mol·L-1) 0.020.820.080.08
容器丙中乙醇的体积分数为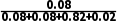 ×100%=8%,D正确。
×100%=8%,D正确。
[模拟演练]
4.(2025·呼和浩特一模)恒温恒容密闭容器中,在某催化剂表面上发生氨分解反应:2NH3(g)N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化如下表所示,下列说法正确的是( )
号 | 
c(NH3)/(10-3 mol·L-1) 表面积/cm2 | 0 | 20 | 40 | 60 | 80 |
① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
② | a | 1.20 | 0.80 | 0.40 | x | |
③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
A.相同条件下,增加氨气浓度或增大催化剂的表面积,反应速率增大
B.实验①,20~40 min,v(N2)=1.00×10-5mol·L-1·min-1
C.实验②,60 min时处于平衡状态,且x>0.20
D.实验③,当混合气体密度保持不变时,反应达到平衡状态
答案 B
解析实验①、实验②中0~20min、20~40min 氨气浓度变化量都是4.00×10-4mol·L-1,实验③中60min时反应达到平衡状态,实验①和实验②催化剂表面积相同,实验①中氨气初始浓度是实验②中氨气初始浓度的两倍,实验①60min时反应未达到平衡状态,相同条件下,增加氨气浓度,反应速率并没有增大,A错误;实验①中,20~40min,
v(NH3)=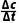 =
=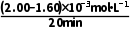 =2.00×10-5mol·L-1·min-1,则v(N2)=
=2.00×10-5mol·L-1·min-1,则v(N2)=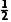 v(NH3)=1.00×10-5mol·L-1·min-1,B正确;催化剂表面积大小只影响反应速率,不影响平衡,实验③中氨气初始浓度与实验①中一样,实验③达到平衡时氨气浓度为4.00×10-4mol·L-1,则实验①达到平衡时氨气浓度也为4.00×10-4mol·L-1,而恒温恒容条件下,实验②中氨气初始浓度小于实验①中的,相当于减小压强,平衡正向移动,因此实验②中60min时处于平衡状态,x<0.2,C错误;实验③,恒温恒容密闭容器中,混合气体质量不变,密度保持恒定,不能说明反应达到平衡状态,D错误。
v(NH3)=1.00×10-5mol·L-1·min-1,B正确;催化剂表面积大小只影响反应速率,不影响平衡,实验③中氨气初始浓度与实验①中一样,实验③达到平衡时氨气浓度为4.00×10-4mol·L-1,则实验①达到平衡时氨气浓度也为4.00×10-4mol·L-1,而恒温恒容条件下,实验②中氨气初始浓度小于实验①中的,相当于减小压强,平衡正向移动,因此实验②中60min时处于平衡状态,x<0.2,C错误;实验③,恒温恒容密闭容器中,混合气体质量不变,密度保持恒定,不能说明反应达到平衡状态,D错误。
5.(2025·辽宁抚顺六校协作体模拟)二氧化碳可氧化乙烷制备乙烯,主要发生如下两个反应:
Ⅰ.C2H6(g)+CO2(g)C2H4(g)+H2O(g)+CO(g) ΔH1>0
Ⅱ.C2H6(g)+2CO2(g)4CO(g)+3H2(g) ΔH2>0
向10 L的恒容密闭容器中投入2 mol C2H6和3 mol CO2,不同温度下,测得5 min时(反应均未达到平衡)的相关数据如下表,下列说法错误的是( )
温度/K | T1 | T2 | T3 |
乙烷转化率/% | 2.0 | 12.0 | 20.0 |
乙烯选择性/% | 95.0 | 75.0 | 60.0 |
注:乙烯选择性=×100%
A.反应Ⅰ的平衡常数:K(T1 K)<K(T2 K)<K(T3 K)
B.温度升高对反应Ⅱ更有利
C.其他条件不变,容器内改为恒压,乙烷平衡转化率增大
D.T2 K时,0~5 min内,v(CO)=4.8×10-4 mol·L-1·min-1
答案 D
解析 ΔH1>0、ΔH2>0,则反应Ⅰ、Ⅱ均为吸热反应,升高温度,平衡正向移动,平衡常数增大,乙烷的转化率升高,由表格数据可知:T1<T2<T3,所以K(T1K)<K(T2K)<K(T3K),故A正确;由表格数据可知,升高温度,乙烷转化率增大,但是乙烯选择性降低,说明升高温度对反应Ⅱ更有利,故B正确;其他条件不变,容器内改为恒压,相当于减小压强,反应Ⅰ、反应Ⅱ平衡正向移动,乙烷的平衡转化率增大,故C正确;T2K时,乙烷的转化率为12.0%,可得转化的乙烷的总物质的量为2mol×12.0%=0.24mol,而此温度下乙烯的选择性为75%,则转化为乙烯的乙烷的物质的量为0.24mol×75%=0.18mol,故转化为CO的乙烷的物质的量为0.24mol-0.18mol=0.06mol,根据反应方程式可得,生成CO的物质的量为0.18mol+0.06mol×4=0.42mol,则0~5min内,v(CO)=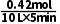 =8.4×10-3mol·L-1·min-1,故D错误。
=8.4×10-3mol·L-1·min-1,故D错误。
6.(2025·辽宁名校联盟二模)利用焦炭处理NOx涉及的主要反应如下:
①2NO(g)+O2(g)===2NO2(g) ΔH<0;
②2C(s)+2NO2(g)N2(g)+2CO2(g) ΔH<0。
向2 L恒容密闭容器中通入2 mol NO、1 mol O2和适量焦炭,分别在X、Y两种不同催化剂作用下发生反应,10 min后测得脱氮率(即NOx的转化率)随温度变化的关系如图所示。

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享