n
微点突破3 化学键 共价键的形成 电子式

1.共价键、离子键、金属键的比较
| 共价键 | 离子键 | 金属键 |
存在 | 分子或物质内部 |
强弱判断 | 键长越短,键能越大,共价键越强 | ①电荷越大,离子键越强;②成键的阴、阳离子半径越小,离子键越强 | ①与金属阳离子所带电荷成正比; ②与阳离子半径成反比; ③与价电子数多少成正比 |
对物质性 质的影响 | 化学性质 | 物理性质和化学性质 | 物理性质和化学性质 |
2.共价键
(1)共价键的类型
按成键原子间共用电子对的数目 | 单键、双键和三键 |
按共用电子对是否偏移 | 极性键和非极性键 |
按原子轨道的重叠方式 | σ键和π键 |
(2)σ键与π键的形成图示
①s⁃s σ键:
②s⁃p σ键:
③p⁃p σ键:
④p⁃p π键:
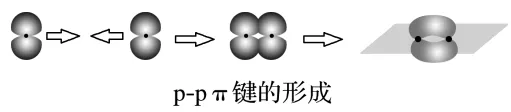
(3)键参数与物质性质的关系

一般情况:元素非金属性越强原子半径越小共价键键长越短键能越大。
(4)共价键的极性对物质性质的影响
①共价键的极性由成键两原子的电负性(吸引电子能力)差异决定,电负性差值越大,键的极性越大。
②共价键的极性还与周围化学环境有关(诱导效应),连有推电子基团的极性减弱,连有吸电子基团的极性增强。

一、电子式的规范书写
1.电子式书写及错因分析
(1)H2O2的电子式为
错因:未分清化合物的类型;正确: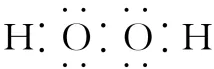 。
。
(2)CO2的电子式为
错因:原子间成键数目(共用电子对数)不清楚;正确: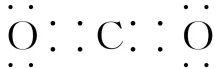 。
。
(3)HClO的电子式为
错因:不清楚原子间的连接顺序;
正确: 。
。
(4)Na2S的电子式为
错因:同种微粒不能合并;
正确: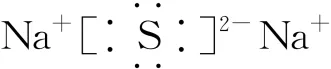 。
。
(5)NH3的电子式为
错因:漏掉未成键电子对(孤电子对);
正确: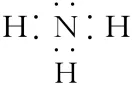 。
。
二、共价键的极性及其对物质性质的影响
2.(2023·天津,11)下表列出25 ℃时不同羧酸的pKa(即-lg Ka)。根据表中的数据推测,结论正确的是( )
羧酸 | CH3COOH | CH2FCOOH | CH2ClCOOH | CH2BrCOOH |
pKa | 4.76 | 2.59 | 2.87 | 2.90 |
A.酸性强弱:CH2ICOOH>CH2BrCOOH
B.对键合电子的吸引能力强弱:F <Cl<Br< span> </Cl<Br<>
C.25 ℃时的pKa大小:CHF2COOH <CH< span> </CH<>2FCOOH
D.25 ℃时0.1 mol·L-1溶液的碱性强弱:CH3COONa <CH< span> </CH<>2ClCOONa
答案 C
解析根据电负性:F>Cl>Br>I,CH2FCOOH、CH2ClCOOH、CH2BrCOOH的酸性逐渐减弱,则酸性:CH2ICOOH <CH< span> </CH<>2BrCOOH,A错误;电负性越大,对键合电子的吸引能力越强,电负性:F>Cl>Br,对键合电子的吸引能力强弱:F>Cl>Br,B错误;F是吸电子基团,F原子个数越多,吸电子能力越强,使得羧基中O—H极性增强,更易电离,酸性增强,则25℃时的pKa大小:CHF2COOH <CH< span> </CH<>2FCOOH,C正确;根据pKa知,相同浓度下酸性:CH3COOH <CH< span> </CH<>2ClCOOH,酸性越强,其对应盐的水解程度越弱,碱性越弱,则相同浓度下碱性:CH2ClCOONa <CH< span> </CH<>3COONa,D错误。
3.[2024·浙江6月选考,17(3)]化合物HA、HB、HC和HD的结构如图。
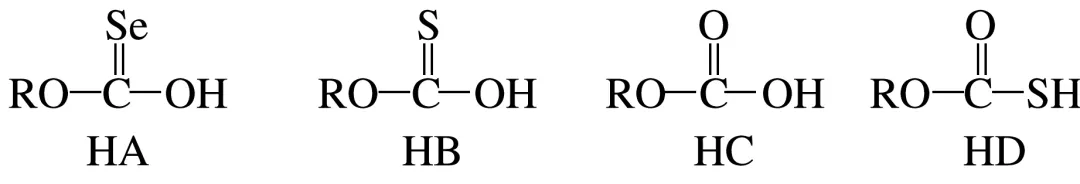
①HA、HB和HC中羟基与水均可形成氢键(—O—H…OH2),按照氢键由强到弱对三种酸排序:,请说明理由:。
②已知HC、HD钠盐的碱性:NaC>NaD,请从结构角度说明理由:。
答案①HC>HB>HA O、S、Se的电负性逐渐减小,键的极性:C==O>C==S>C==Se,使得HA、HB、HC中羟基的极性逐渐增大,羟基与H2O形成的氢键逐渐增强 ②原子半径:S>O,键长:S—H>O—H,S—H更易断键电离,因此HD酸性更强,碱性:NaC>NaD

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享