n
微点突破8 实验操作、现象、结论及原因的规范描述

1.物质检验、鉴别的答题规范
取样,加入××试剂,若有××现象,则有××物质,否则,没有××物质。
2.化学反应现象的描述
一实质:描述物质的现象实质是指明现象承载的物质。特殊的实验目的,有特别的现象或操作描述。
两原则:①一般说来,生成的每一种物质都需尽可能地通过现象描述;②已知的反应物描述“色态+试剂名”;生成物只描述“色态”,不描述“物质名”(物质是通过现象分析出来的,生成水除外)。
四导向:①反应物的逐渐消失;②生成物的出现[生成物质的颜色和状态、烟或雾、气泡以及程度(立即、大量)等];③过程现象(如剧烈反应、发光、发热等);④装置的变化(如液面升降、气球膨胀等)。
完全反应的现象:不足量的反应物全部消失(如固体完全溶解);过量的物质不变(如通入的气体反应物与出口检测到的量相同,气压不变),不再出现生成物的现象(如不再产生气泡);现象突变(终点现象)。
3.实验原因或理由的答题规范
“有理”——化学原理,“有据”——事实依据
可采取以下两种方式:
①“正说”——“直接原因+根本目的”
②“反说”——“如果……就……”
4.“实验方案”与“实验操作”的答题区别
实验方案主要是指为达到目的进行的原理选用、实验方法、实验步骤等概念性的描述,强调做什么;如:“用标准溶液滴定至终点”。
实验操作是确保实验成功的具体操作过程:仪器选用(匹配、规格)、过程控制(条件要求、终点判断)、操作技能(如浓硫酸的稀释、分液上下层溶液的处理)等,强调怎么做;如:“当滴加半滴××溶液后,溶液突变成××色,且30秒内不改变”,即为滴定终点。

1.[2024·全国甲卷,27(1)(3)(4)]CO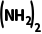 ·H2O2(俗称过氧化脲)是一种消毒剂,实验室中可用尿素与过氧化氢制取,反应方程式如下:
·H2O2(俗称过氧化脲)是一种消毒剂,实验室中可用尿素与过氧化氢制取,反应方程式如下:
CO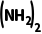 +H2O2===CO
+H2O2===CO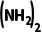 ·H2O2
·H2O2
(一)过氧化脲的合成
烧杯中分别加入25 mL 30% H2O2(ρ=1.11 g·cm-3)、40 mL蒸馏水和12.0 g尿素,搅拌溶解。30 ℃下反应40 min,冷却结晶、过滤、干燥,得白色针状晶体9.4 g。
(二)过氧化脲性质检测
Ⅰ.过氧化脲溶液用稀H2SO4酸化后,滴加KMnO4溶液,紫红色消失。
Ⅱ.过氧化脲溶液用稀H2SO4酸化后,加入KI溶液和四氯化碳,振荡,静置。
回答下列问题:
(1)过滤中使用到的玻璃仪器有(写出两种即可)。
(3)性质检测 Ⅱ 中的现象为。
性质检测 Ⅰ 和 Ⅱ 分别说明过氧化脲具有的性质是。
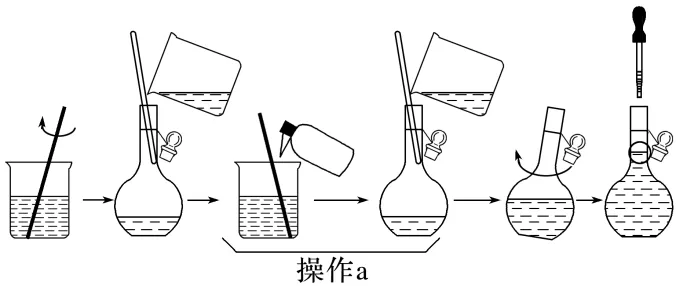
(4)下图为“溶液配制”的部分过程,操作a应重复3次,目的是,
定容后还需要的操作为。
答案 (1)烧杯、漏斗、玻璃棒(任选两种作答)
(3)液体分层,上层为无色,下层为紫红色
还原性、氧化性 (4)避免溶质损失 盖好瓶塞,反复上下颠倒、摇匀
解析(3)在过氧化脲的性质检测中,检测Ⅰ中过氧化脲用稀硫酸酸化,加入高锰酸钾溶液,紫红色消失,说明过氧化脲被酸性高锰酸钾溶液氧化,体现了过氧化脲的还原性;检测Ⅱ中过氧化脲用稀硫酸酸化,加入KI溶液和四氯化碳溶液,过氧化脲会将KI氧化为I2,体现了过氧化脲的氧化性,生成的I2在四氯化碳中溶解度更大,会溶于四氯化碳溶液,且四氯化碳密度大于水,振荡,静置后出现的现象为液体分层,上层为无色,下层为紫红色。
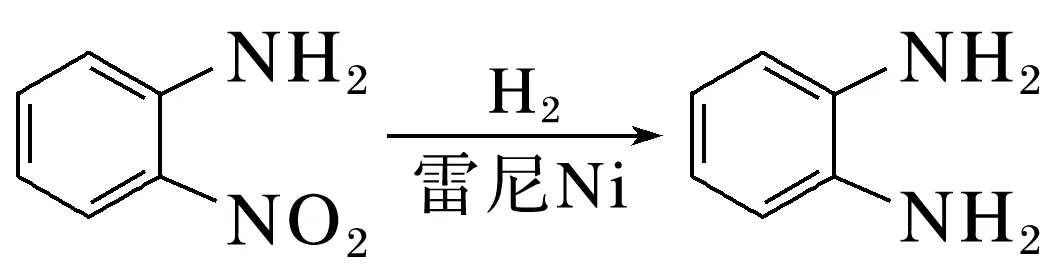
2.[2023·湖南,15(4)(5)(6)(7)(8)]金属Ni对H2有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应,将块状Ni转化成多孔型雷尼Ni后,其催化活性显著提高。
已知:①雷尼Ni暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”。
邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存H2和监测反应过程。
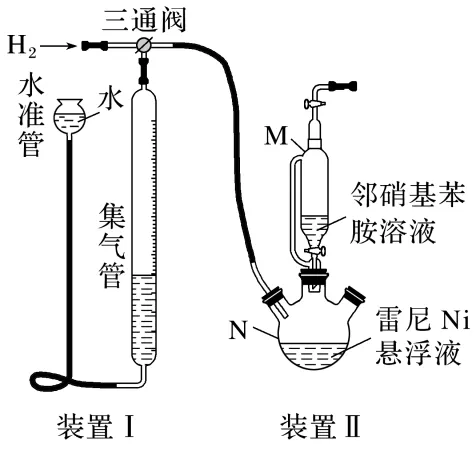
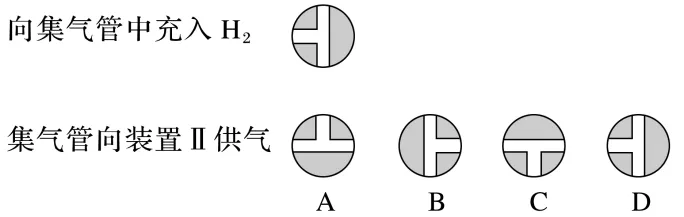
(4)向集气管中充入H2时,三通阀的孔路位置如下图所示:发生氢化反应时,集气管向装置Ⅱ供气,此时孔路位置需调节为。
(5)仪器M的名称是。
(6)反应前应向装置Ⅱ中通入N2一段时间,目的是。
(7)如果将三颈烧瓶N中的导气管口插入液面以下,可能导致的后果是。
(8)判断氢化反应完全的现象是。
答案 (4)B (5)恒压滴液漏斗
(6)排尽装置内的空气,防止雷尼Ni自燃 (7)雷尼Ni堵塞导管、管道中气流不稳,不利于监测反应过程 (8)集气管中液面保持不变
解析(4)根据向集气管中通入H2时三通阀的孔路位置,可确定集气管向装置Ⅱ中供气时,应保证只有下侧、右侧孔路通气,故B正确。(6)根据题给信息可知,雷尼Ni暴露在空气中可以自燃,故反应前向装置Ⅱ中通入N2一段时间,目的是排尽装置中的空气,防止雷尼Ni自燃。(8)反应完成后,氢气不再被消耗,则集气管中液面不再发生变化。
3.(2025·河南部分学校联考)某化学学习小组探究Fe3+在溶液中的颜色变化,进行以下实验。
| 试剂 | 加热前溶液颜色 | 加热后溶液颜色 |
实验Ⅰ | Fe(NO3)3溶液+蒸馏水 | 棕黄色 | 深棕色 |
实验Ⅱ | Fe(NO3)3溶液+HNO3 | 几乎无色 | 几乎无色 |
实验Ⅲ | FeCl3溶液+HNO3 | 黄色 | 深黄色 |
已知:水溶液中,[Fe(H2O)6]3+几乎无色,[FeCl4(H2O)2]-为黄色;[Fe(H2O)6]3+水解生成[Fe(H2O)6-n (OH)n]3-n(棕黄色)。
(1)由实验可知,对[Fe(H2O)6]3+水解影响大小:H+的影响(填“大于”“等于”或“小于”)温度的影响。
(2)设计实验证明实验Ⅲ中溶液呈黄色的原因是Fe3++4Cl-+2H2O[FeCl4(H2O)2]-:。
答案 (1)大于 (2)向实验Ⅱ溶液中加入NaCl溶液后变为黄色,加热后变为深黄色
解析(1)由实验Ⅰ中加热前后溶液颜色无明显变化、实验Ⅱ中加热前后溶液几乎无色可知,氢离子浓度对[Fe(H2O)6]3+水解平衡的影响大于温度的影响。(2)由方程式可知,增大实验Ⅱ溶液中氯离子浓度,平衡会正向移动,溶液中[FeCl4(H2O)2]-浓度增大,会使溶液变为黄色,则证明实验Ⅲ中溶液呈黄色的实验方案为向实验Ⅱ溶液中加入NaCl溶液后变为黄色,加热后变为深黄色。

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享