n
第7练 创新探究类实验
[分值:50分]
(1~4题,每小题5分)
1.(2025·湖北省T8联盟模拟)2,6⁃二溴吡啶是合成阿伐斯汀(抗组胺药)中间体,实验室制备过程如下:
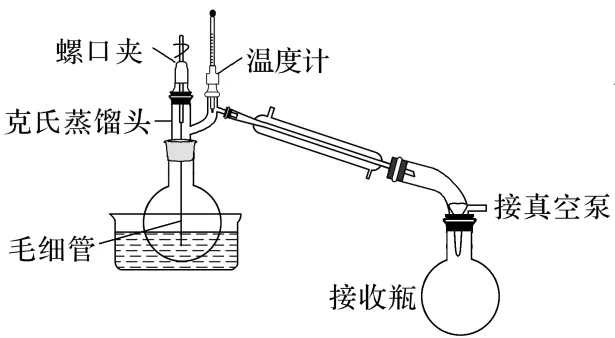
步骤1:在三颈烧瓶中加入2,6⁃二氯吡啶、冰乙酸,搅拌,溶解后,在110 ℃下,通入HBr。
步骤2:反应完毕,利用如图装置回收乙酸。
步骤3:冷却至室温,析出晶体,过滤。母液回收溶剂,冷却,析出晶体,过滤,合并两次晶体,空气干燥。
已知:乙酸、2,6⁃二氯吡啶、2,6⁃二溴吡啶的沸点依次为117.9 ℃、206 ℃、249 ℃。油浴温度:100~250 ℃;砂浴温度:220~350 ℃。
下列叙述错误的是( )
A.步骤1中采用“油浴”加热三颈烧瓶
B.如图装置中毛细管起防暴沸和搅拌作用
C.接收瓶最先收集到2,6⁃二溴吡啶
D.实验中乙酸作溶剂,回收可循环利用
答案 C
解析步骤1反应温度为110℃,在油浴温度范围内,A项正确;通过调节“螺口夹”,微量空气进入烧瓶,产生的小气泡可起到防暴沸、搅拌等作用,B项正确;蒸馏时沸点最低的物质最先气化,接收瓶最先收集到乙酸,C项错误;步骤1中2,6⁃二氯吡啶溶于乙酸(相似相溶),乙酸作溶剂,回收乙酸可循环利用,D项正确。
2.(2025·昆明模拟)已知乙烯利固体与氢氧化钾溶液反应可以制备乙烯,反应原理如下所示:
 2==CH2↑+K3PO4+3H2O
2==CH2↑+K3PO4+3H2O
实验装置如图所示。下列说法错误的是( )
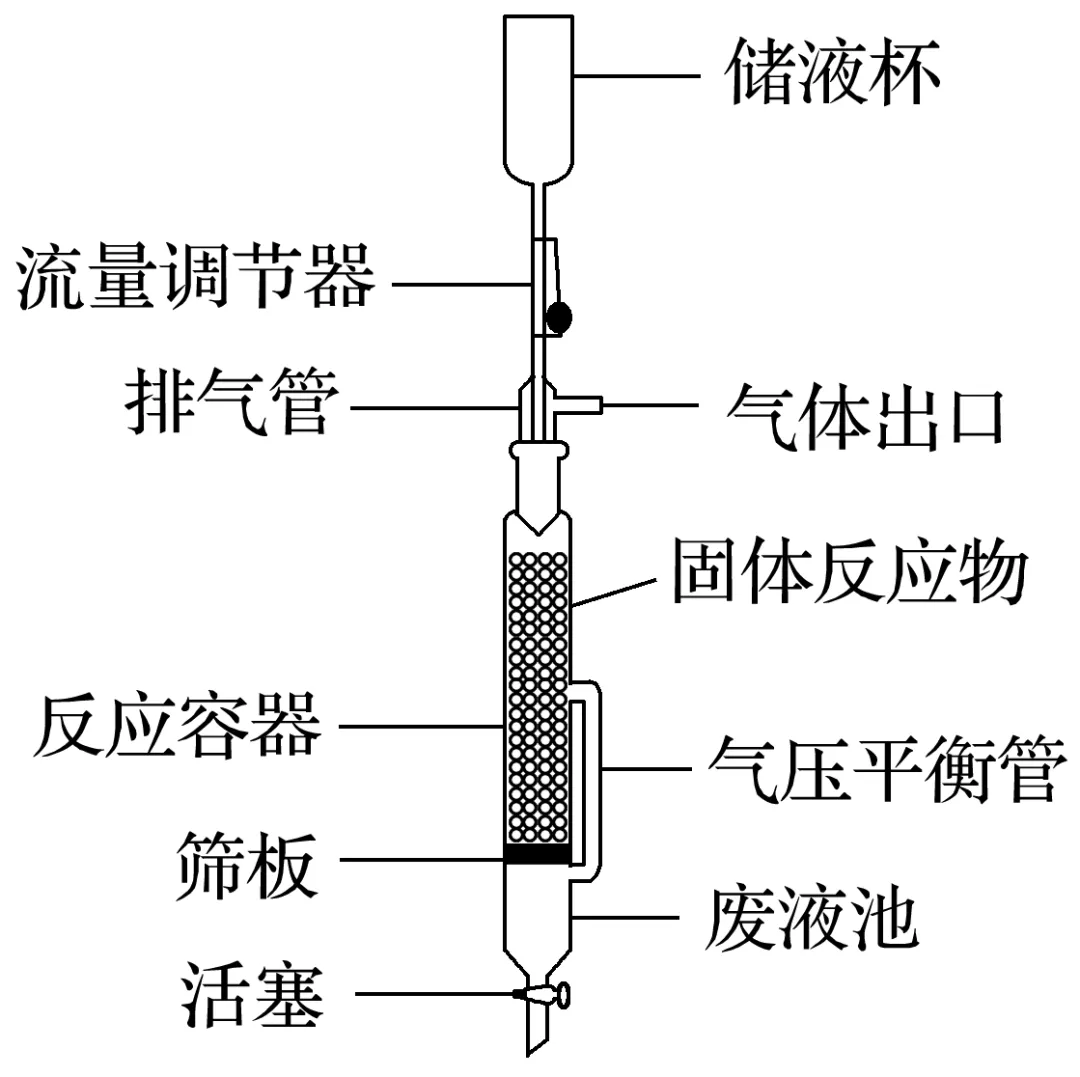
A.流量调节器可以控制反应速率
B.气压平衡管的作用是平衡压强,使液体顺利流下
C.气体出口逸出的乙烯可以用排空气法收集
D.该方法制得的乙烯比浓硫酸使乙醇脱水制得的乙烯纯净
答案 C
解析流量调节器可以控制液体反应物的流量,从而控制反应速率,A正确;气压平衡管使上下两部分连通,作用是平衡压强,使液体顺利流下,B正确;乙烯的摩尔质量为28g·mol-1,空气的平均摩尔质量为29g·mol-1,相差不大,不能用排空气法收集乙烯,C错误;浓硫酸使乙醇脱水制得的乙烯中存在CO2、SO2等杂质,而该方法制得的乙烯较纯净,D正确。
3.(2025·河南焦作模拟)BaH2常用作强还原剂、供氢剂和真空管除气剂,遇水蒸气剧烈反应。某小组利用如图装置(部分夹持装置未画出)制备Fe(OH)2和BaH2。下列叙述正确的是( )
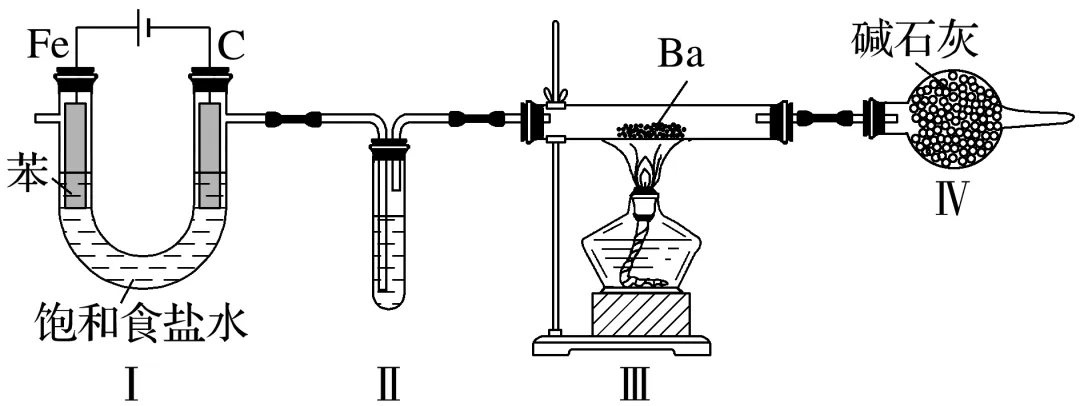
A.装置Ⅱ中的试剂为NaOH溶液,作用是吸收气体中的Cl2
B.可以较长时间观察到装置Ⅰ中产生白色沉淀
C.装置Ⅳ的作用是干燥并吸收尾气
D.用水可以检验装置Ⅲ中钡是否过量
答案 B
解析Ⅰ为电解饱和食盐水的装置,C为阴极,H+得到电子生成H2,装置Ⅱ中的试剂为浓硫酸,用于干燥H2,装置Ⅲ中H2和Ba反应生成BaH2,装置Ⅳ的作用是防止空气中的水蒸气进入装置Ⅲ,以此解答。Ⅰ为电解饱和食盐水的装置,Fe为阳极,电极反应式为Fe-2e-===Fe2+,阴极产生OH-,该装置中阳极用苯隔绝空气,可以较长时间观察到Fe(OH)2白色沉淀,故B正确;由分析可知,装置Ⅳ的作用是防止空气中的水蒸气进入装置Ⅲ,H2不能用碱石灰除去,故C错误;Ba和BaH2都可以和水反应,不能用水检验装置Ⅲ中钡是否过量,故D错误。
4.(2025·湖南常德模拟)在烟火气息里探索是化学人的乐趣。某兴趣小组为测定面包膨松剂中碳酸氢铵(杂质受热不分解)的含量,设计的实验装置如图所示。下列有关说法正确的是( )
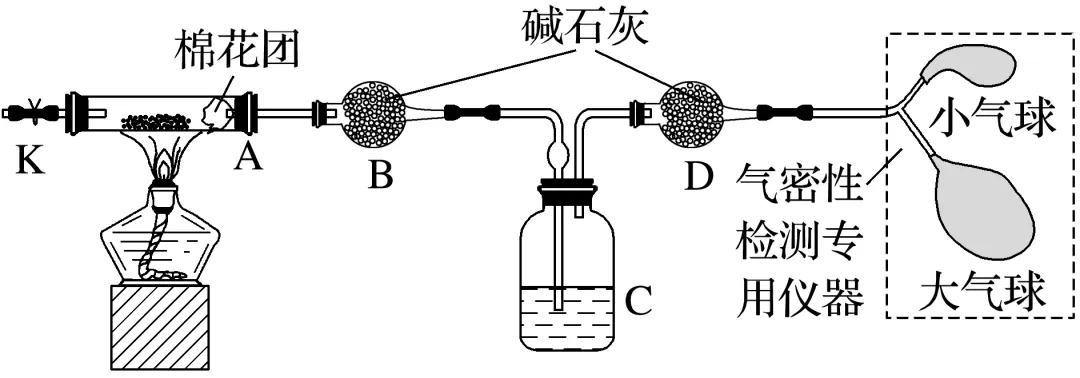
A.连接好装置,关闭K,挤压大气球数次,小气球不断增大,停止鼓气后小气球大小保持不变,则说明气密性良好
B.确保气密性良好后,方可取下气密性检测专用仪器,立即点燃酒精灯进行实验
C.若根据装置C增重计算,则装置D可省略
D.实验前、后均应打开K并通入N2,否则均可导致结果偏大
答案 A
解析确保气密性良好后,方可取下气密性检测专用仪器,先通N2,将装置内空气(空气内含水、CO2)赶出,再点燃酒精灯进行实验,B错误;装置D的作用是吸收空气中的水蒸气和二氧化碳,防止空气中的水和CO2进入装置C,引起实验误差,C错误;实验后打开K并通入N2,将生成的水蒸气、二氧化碳和NH3全部赶入装置B、C中,否则吸收不充分会导致结果偏小,D错误。
5.(14分)(2025·河南四市联考二模)某实验小组设计实验测定Pb3O4组成中PbO、PbO2的物质的量之比。
步骤1:Pb3O4的分解。
用托盘天平称取0.5 g干燥的Pb3O4置于小烧杯中,加入2 mL 6 mol·L-1 HNO3溶液,用玻璃棒搅拌,使之充分反应,可以看到红色的Pb3O4快速变为棕黑色的PbO2。过滤分离混合物,并用少量蒸馏水多次洗涤,得到固体;将洗涤液并入滤液中。
步骤2:PbO含量的测定。
将上述滤液全部转移到锥形瓶中,加入调节剂使溶液pH为5~6,用c1 mol·L-1EDTA(乙二胺四乙酸)溶液滴定至终点,消耗EDTA溶液体积为V1 mL。
步骤3:PbO2含量的测定。
将上述固体连同滤纸一并置于另一锥形瓶中,往其中加入30 mL HAc⁃NaAc溶液,再向其中加入0.8 g KI固体,摇动锥形瓶,使PbO2全部反应而溶解,此时溶液呈透明棕色。用c2 mol·L-1 Na2S2O3标准溶液滴定至溶液呈浅黄色时,加入1 mL 2%淀粉溶液,继续滴定至溶液蓝色刚好褪去为止,消耗滴定液体积为V2 mL。有关反应如下:
Pb3O4+4HNO3===PbO2+2Pb(NO3)2+2H2O
Pb2++EDTA4-===PbEDTA2-
PbO2+4KI+4HAc===PbI2(黄色)+I2+2H2O+4KAc
I2+2S2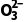 ===2I-+S4
===2I-+S4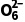
(1)步骤1中,不能用硫酸替代硝酸,其原因是。用少量蒸馏水多次洗涤固体的主要目的是除去固体表面阳离子(填离子符号)。过滤时用到的玻璃仪器有。
(2)步骤3中,固体连同滤纸一起置于锥形瓶中,其目的是。
(3)根据上述数据计算Pb3O4中PbO、PbO2的物质的量之比为(用含c1、V1、c2、V2的代数式表示)。
(4)步骤2滴定过程中,若滴定前俯视读数,滴定后仰视读数,其测定结果(填“偏高”“偏低”或“无影响”)。
(5)步骤3中,加入HAc⁃NaAc溶液调节pH,如果加入HAc过多,测定结果偏低,其原因是(用离子方程式表示)。
答案 (1)PbSO4难溶于水 Pb2+ 烧杯、漏斗、玻璃棒 (2)避免固体损失,造成较大误差 (3)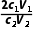 (4)偏高 (5)S2
(4)偏高 (5)S2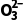 +2HAc===SO2↑+S↓+H2O+2Ac-
+2HAc===SO2↑+S↓+H2O+2Ac-
解析(3)根据PbO2+4KI+4HAc===PbI2(黄色)+I2+2H2O+4KAc、I2+2S2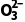 ===2I-+S4
===2I-+S4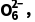 n(PbO2)=n(I2)=
n(PbO2)=n(I2)=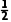 n(Na2S2O3)=
n(Na2S2O3)=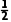 c2V2×10-3mol;根据Pb2++EDTA4-===PbEDTA2-,n(PbO)=n(EDTA)=c1V1×10-3mol;根据上述数据计算Pb3O4中PbO、PbO2的物质的量之比为
c2V2×10-3mol;根据Pb2++EDTA4-===PbEDTA2-,n(PbO)=n(EDTA)=c1V1×10-3mol;根据上述数据计算Pb3O4中PbO、PbO2的物质的量之比为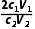 。(4)步骤2滴定过程中,若滴定前俯视读数,滴定后仰视读数,消耗标准液体积偏大,PbO含量偏大,其测定结果偏高。(5)步骤3中,加入HAc⁃NaAc溶液调节pH,如果加入HAc过多,发生反应:S2
。(4)步骤2滴定过程中,若滴定前俯视读数,滴定后仰视读数,消耗标准液体积偏大,PbO含量偏大,其测定结果偏高。(5)步骤3中,加入HAc⁃NaAc溶液调节pH,如果加入HAc过多,发生反应:S2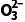 +2HAc=== SO2↑+S↓+H2O+2Ac-,PbO2含量偏大,所以测定结果偏低。
+2HAc=== SO2↑+S↓+H2O+2Ac-,PbO2含量偏大,所以测定结果偏低。
6.(16分)(2025·安徽池州二模)某校课题小组制备SO2并探究SO2分别与BaCl2溶液、Ba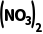 溶液的反应。
溶液的反应。
(1)实验Ⅰ:
室温下,按图示组装仪器(夹持装置已省略),检查装置气密性后向B中滴加一定量50%的H2SO4溶液,B中迅速产生大量气体,3分钟后D中出现白色浑浊,并闻到有刺激性气味。查资料可知,在一定温度和湿度的条件下,有少量硫酸可以随气体逸出。据此回答:
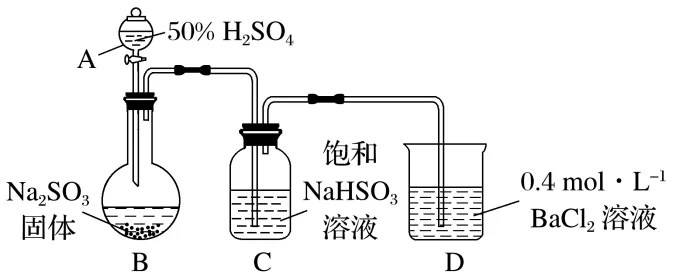
①仪器A是(填仪器名称)。
②按上图组装好装置并检查装置气密性,添加试剂和药品后,第一步操作是,使50%硫酸顺利滴下并与Na2SO3固体充分反应。
③装置C的作用是。
(2)D中出现白色浑浊的理论及可能性分析:
猜测一:SO2溶于水生成H2SO3,继而与BaCl2发生复分解反应,形成BaSO3白色沉淀。
查阅资料:
ⅰ.室温下:H2SO3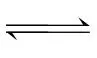 ++
++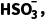 Ka1=1.4×10-2;
Ka1=1.4×10-2;

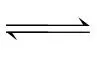 ++
++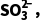 Ka2=6.0×10-8;
Ka2=6.0×10-8;
BaSO3(s)Ba2+(aq)+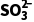 (aq),Ksp=5.0×10-10
(aq),Ksp=5.0×10-10
ⅱ.室温下,H2SO3水溶液中H+、 浓度与H2SO3浓度关系如图所示:
浓度与H2SO3浓度关系如图所示:
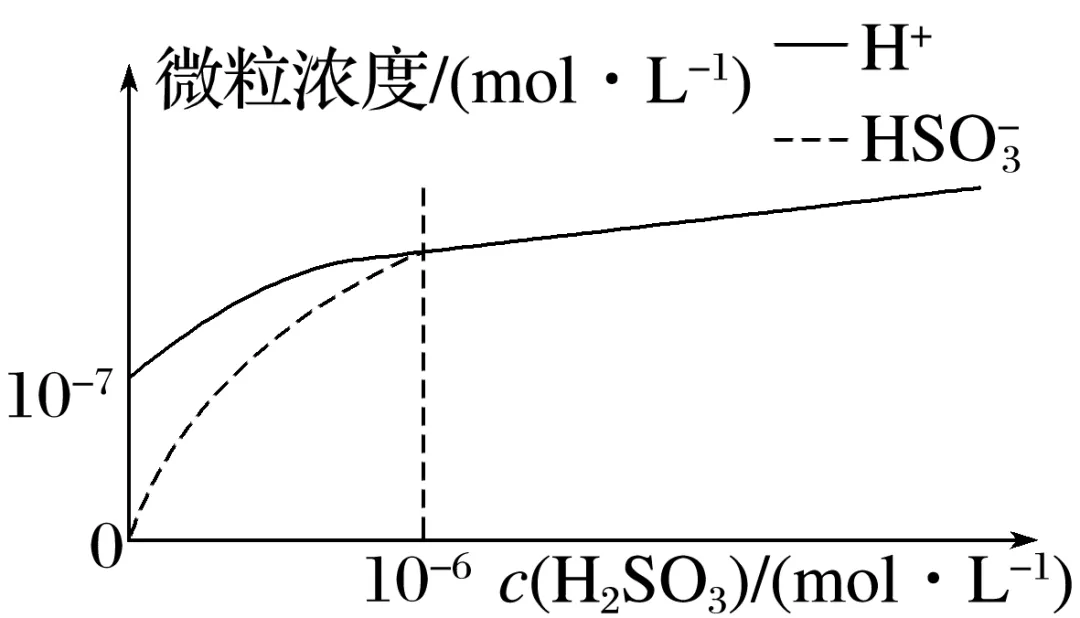
①如图可知:当c(H2SO3)≥10-6 mol·L-1时,c(H+)与c( )几乎相等,用化学用语及简洁文字解释:。
)几乎相等,用化学用语及简洁文字解释:。
②请通过计算判断,在实验Ⅰ条件下(填“可能”或“不可能”)生成BaSO3白色沉淀。
猜测二:SO2具有强还原性,可能被溶液中的O2氧化,继而生成BaSO4白色沉淀。
③写出猜测二对应的化学方程式:。
(3)实验Ⅱ:将装置D中溶液换为Ba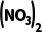 溶液并继续通入SO2,观察到有白色沉淀产生。
溶液并继续通入SO2,观察到有白色沉淀产生。
经检验该白色沉淀为BaSO4。为了确定产生沉淀的原因,该小组成员利用数字化实验并对传感器采集的数据进行了处理,结果如图所示:
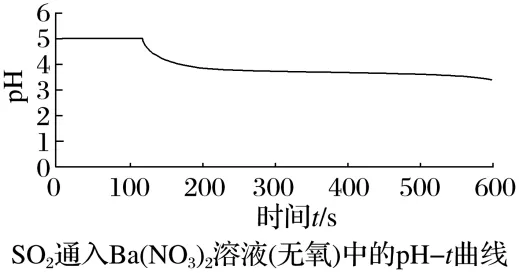
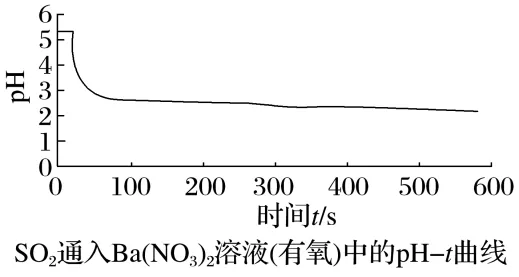
①请写出无氧条件下的离子方程式:。
②比较上图可得出的结论:。
答案 (1)①分液漏斗 ②取下上口玻璃活塞(或使分液漏斗凹槽对准小孔),缓缓旋转下口旋塞 ③除去随SO2气体逸出的硫酸分子,以免对后续实验产生影响 (2)①H2SO3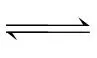 ++
++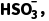 当亚硫酸浓度较大时,电离以第一步为主,所以c(H+)与c(
当亚硫酸浓度较大时,电离以第一步为主,所以c(H+)与c( )几乎相等 ②可能 ③2H2O+O2+2SO2+2BaCl2===2BaSO4↓+ 4HCl(或2H2SO3+O2+2BaCl2===2BaSO4↓+4HCl) (3)①3SO2+
)几乎相等 ②可能 ③2H2O+O2+2SO2+2BaCl2===2BaSO4↓+ 4HCl(或2H2SO3+O2+2BaCl2===2BaSO4↓+4HCl) (3)①3SO2+ +3Ba2++2H2O===3BaSO4↓+2NO+4H+
+3Ba2++2H2O===3BaSO4↓+2NO+4H+
②氧气起主要氧化作用(或其他合理答案)
解析(1)③已知在一定温度和湿度条件下,有少量硫酸会随气体逸出。装置C中盛放的是饱和NaHSO3溶

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享