n
微点突破3 阿伏加德罗常数应用判断

1.以物质的量为核心的化学计算
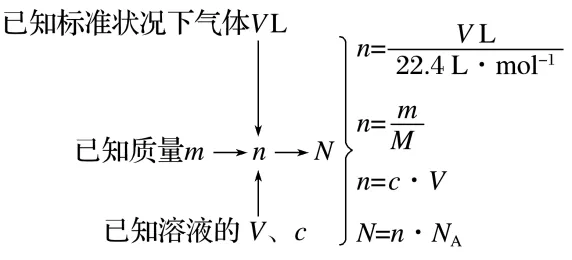
2.混合物中微粒数判断——找共性
 例
例 NA表示阿伏加德罗常数的值,计算指定微粒数目。
NA表示阿伏加德罗常数的值,计算指定微粒数目。
(1)92 g C3H8O3和C7H8混合物中H原子数是。
(2)92 g NO2和N2O4混合物中O原子数是。
(3)0.1 mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数是。
答案 (1)8NA (2)4NA (3)0.3NA
解析(1)两种分子的摩尔质量相同,且每个分子中H原子数同,故92g是1mol,H原子数是8NA。(2)二者最简式同为“NO2”,O原子数为4NA。

3.规避NA应用的陷阱
常设陷阱 | 应用举例(正误判断) |
Ⅰ.溶液体积未知 溶液的体积未知,溶质的物质的量无法计算,所以微粒数也无法计算 | (1)在pH=13的NaOH溶液中,OH-的数目为0.1×6.02×1023 ( × ) (2)0.1 mol·L-1 FeCl3溶液中所含Fe3+的数目小于0.1NA ( × ) |
Ⅱ.标准状况下与非标准状况下的陷阱 气体若在非标准状况下,气体摩尔体积不能用22.4 L·mol-1计算;标准状况下为非气体的物质:SO3、CH3OH、HF等 | (1)常温常压下,22.4 L氯气与足量的镁粉充分反应,转移的电子数为2NA ( × ) (2)标准状况下,22.4 L苯中含有6NA个碳原子 ( × ) |
Ⅲ.不能完全反应的陷阱 可逆反应不能进行到底,如加热条件下,一定量的浓盐酸(浓硫酸)与足量的MnO2(金属铜)不能反应完全 | (1)密闭容器中,1 mol N2与3 mol H2充分反应,生成2 mol NH3 ( × ) (2)50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA ( × ) |
Ⅳ.弱电解质的电离、盐类水解 弱电解质仅部分电离;注意盐类水解引起的粒子数目变化 | (1)1 L 0.1 mol·L-1 CH3COOH溶液中所含H+的数目为0.1NA ( × ) (2)1 L 0.1 mol·L-1 NH4Cl溶液中,N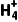 的数目为0.1NA ( × ) 的数目为0.1NA ( × ) |
Ⅴ.存在自由基连锁反应 氯气与CH4反应同时生成CH3Cl、CH2Cl2、CHCl3、CCl4四种氯代物 | 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为NA ( × ) |
4.高考新动向
纵观近年高考试题,将物质结构中的化学键数目、杂化轨道数目、晶胞中粒子的数目等与物质的量融合考查是一种新动向,要特别关注以下几个方面:
(1)区分不同化学键类型:σ键、π键、孤电子对的计算需结合分子结构。
(2)正确分析晶体组成:如Na3AlF6中阳离子仅为Na+,NaHSO4在水溶液中或熔融状态下的电离等。
(3)熟记常考物质的结构,如①苯环中不含碳碳双键;②SiO2晶体中,每个Si原子形成4个Si—O,每个O原子连接2个Si原子;③白磷(P4)为正四面体形,1 mol P4含6 mol P—P σ键;④S8为环状分子,1 mol S8含8 mol S—S。
(4)熟记典型晶胞中微粒的数目,如:1 mol NaCl晶胞中含有4 mol Na+和4 mol Cl-。

[真题精练]
1.(2025·黑吉辽蒙,4)钠及其化合物的部分转化关系如图。设NA为阿伏加德罗常数的值,下列说法正确的是( )
NaClNaNa2O2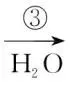
A.反应①生成的气体,每11.2 L(标准状况)含原子的数目为NA
B.反应②中2.3 g Na完全反应生成的产物中含非极性键的数目为0.1NA
C.反应③中1 mol Na2O2与足量H2O反应转移电子的数目为2NA
D.100 mL 1 mol·L-1 NaClO溶液中,ClO-的数目为0.1NA
答案 A
解析反应①为2NaCl(熔融) 2↑,标准状况下,11.2LCl2的物质的量为0.5mol,所含原子的数目为NA,A正确;2.3gNa的物质的量为0.1mol,根据原子守恒可知,0.1molNa完全反应生成Na2O2的物质的量为0.05mol,1个Na2O2中含1个O—O非极性键,故产物中所含非极性键的数目为0.05NA,B错误;反应③的化学方程式为2Na2O2+2H2O===4NaOH+O2↑,故1molNa2O2与足量H2O反应生成0.5molO2,反应转移电子的数目为NA,C错误;NaClO为强碱弱酸盐,ClO-会发生水解,导致ClO-的数目小于0.1NA,D错误。
2↑,标准状况下,11.2LCl2的物质的量为0.5mol,所含原子的数目为NA,A正确;2.3gNa的物质的量为0.1mol,根据原子守恒可知,0.1molNa完全反应生成Na2O2的物质的量为0.05mol,1个Na2O2中含1个O—O非极性键,故产物中所含非极性键的数目为0.05NA,B错误;反应③的化学方程式为2Na2O2+2H2O===4NaOH+O2↑,故1molNa2O2与足量H2O反应生成0.5molO2,反应转移电子的数目为NA,C错误;NaClO为强碱弱酸盐,ClO-会发生水解,导致ClO-的数目小于0.1NA,D错误。
2.(2024·黑吉辽,4)硫及其化合物部分转化关系如图。设NA为阿伏加德罗常数的值,下列说法正确的是( )
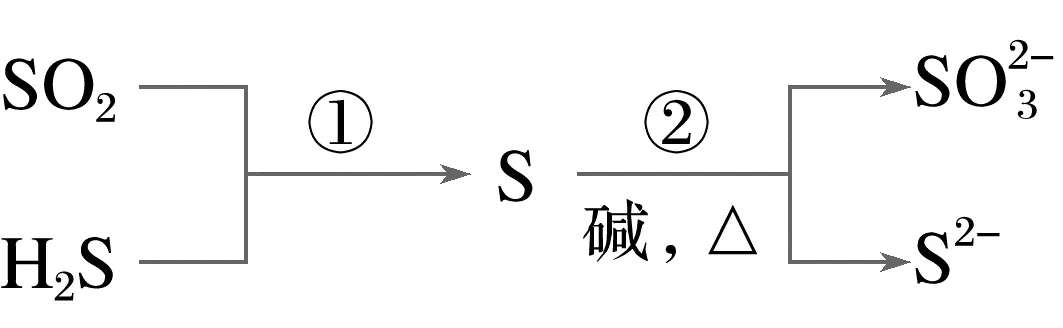
A.标准状况下,11.2 L SO2中原子总数为0.5NA
B.100 mL 0.1 mol·L-1Na2SO3溶液中,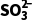 数目为0.01NA
数目为0.01NA
C.反应①每消耗3.4 g H2S,生成物中硫原子数目为0.1NA
D.反应②每生成1 mol还原产物,转移电子数目为2NA
答案 D
解析标准状况下,11.2LSO2的物质的量为0.5mol,原子总数为1.5NA,A项错误;S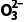 为弱酸阴离子,其在水中易发生水解,100mL0.1molL-1Na2SO3溶液中S
为弱酸阴离子,其在水中易发生水解,100mL0.1molL-1Na2SO3溶液中S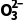 数目小于0.01NA,B项错误;反应①的化学方程式为SO2+2H2S===3S↓+2H2O,3.4gH2S的物质的量为0.1mol,完全反应生成0.15molS,生成的S原子数目为0.15NA,C项错误;反应②的离子方程式为3S+6OH-
数目小于0.01NA,B项错误;反应①的化学方程式为SO2+2H2S===3S↓+2H2O,3.4gH2S的物质的量为0.1mol,完全反应生成0.15molS,生成的S原子数目为0.15NA,C项错误;反应②的离子方程式为3S+6OH-
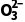 +2S2-+3H2O,还原产物为S2-,单质S得电子,化合价由0价降至-2价,故每生成1molS2-,转移2mol电子,转移电子数目为2NA,D项正确。
+2S2-+3H2O,还原产物为S2-,单质S得电子,化合价由0价降至-2价,故每生成1molS2-,转移2mol电子,转移电子数目为2NA,D项正确。
[模拟预测]
3.(2025·东北三省四市教研联合体一模)利用生石灰和过量焦炭制备乙炔的一种流程如图。设NA为阿伏加德罗常数的值,下列说法错误的是( )
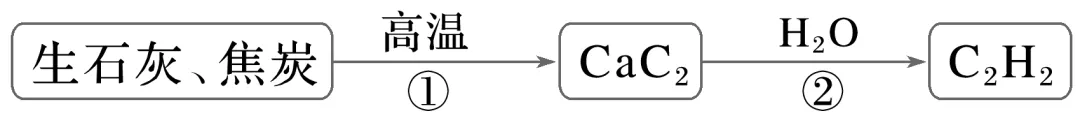
A.反应①每生成1 mol CaC2,转移电子数目为4NA
B.1 mol CaC2中含有的离子数为2NA
C.反应②中,每生成1 mol C2H2,消耗的H2O分子数为2NA
D.标准状况下,11.2 L C2H2中含有π键数为NA
答案 A
解析反应①的化学方程式为CaO+3CCaC2+CO↑,每生成1molCaC2,有2molC由0价降低到-1价,转移电子数目为2NA,A错误;CaC2中含有Ca2+和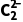 molCaC2中含有的离子数为2NA,B正确;反应②的化学方程式为CaC2+2H2O—→CH≡CH↑+Ca(OH)2,每生成1molC2H2,消耗的H2O分子数为2NA,C正确;C2H2结构简式为CH≡CH,1个碳碳三键中有2个π键,标准状况下,11.2LC2H2(即0.5mol)中含有π键数为NA,D正确。
molCaC2中含有的离子数为2NA,B正确;反应②的化学方程式为CaC2+2H2O—→CH≡CH↑+Ca(OH)2,每生成1molC2H2,消耗的H2O分子数为2NA,C正确;C2H2结构简式为CH≡CH,1个碳碳三键中有2个π键,标准状况下,11.2LC2H2(即0.5mol)中含有π键数为NA,D正确。
4.(2025·辽宁抚顺六校协作体模拟)含氮化合物的部分转化关系如图,设NA为阿伏加德罗常数的值。下列说法正确的是( )
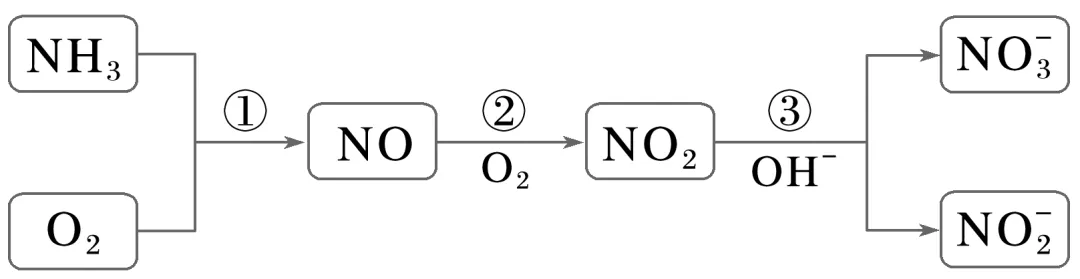
A.反应①每消耗32 g O2,生成NO分子的数目为2NA
B.标准状况下,22.4 L NO2中含有原子的数目为3NA
C.1 L 1 mol·L-1NaNO2溶液中,含有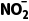 的数目为NA
的数目为NA
D.反应③中每生成1 mol氧化产物,转移电子的数目为NA
答案 D
解析反应①的化学方程式为4NH3+5O2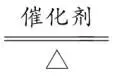 2O;反应②的化学方程式为2NO+O2===2NO2;反应③的化学方程式为2NO2+2OH-===N
2O;反应②的化学方程式为2NO+O2===2NO2;反应③的化学方程式为2NO2+2OH-===N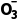 +
+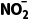 +H2O,据此分析作答。根据反应①可知,每消耗32gO2,生成NO分子的数目为0.8NA,A项错误;标准状况下,NO2不是气体,无法计算其原子数,B项错误;
+H2O,据此分析作答。根据反应①可知,每消耗32gO2,生成NO分子的数目为0.8NA,A项错误;标准状况下,NO2不是气体,无法计算其原子数,B项错误;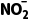 在溶液中会发生水解,1L1mol·L-1NaNO2溶液中,含有
在溶液中会发生水解,1L1mol·L-1NaNO2溶液中,含有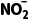 的数目小于NA,C项错误;反应③中N
的数目小于NA,C项错误;反应③中N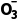 为氧化产物,该反应每生成1个
为氧化产物,该反应每生成1个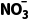 转移1个电子,则每生成1molN
转移1个电子,则每生成1molN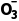 ,转移电子的数目为NA,D项正确。
,转移电子的数目为NA,D项正确。
5.(2025·东北三省三校一模)含钴配合物应用广泛,关于反应2CoCl2+2NH4Cl+10NH3+H2O2 3)6]Cl3+2H2O,下列分析正确的是(设NA为阿伏加德罗常数的值)( )
3)6]Cl3+2H2O,下列分析正确的是(设NA为阿伏加德罗常数的值)( )
A.反应物NH3分子和产物中NH3分子键角相等
B.产物H2O是还原产物,每生成1 mol H2O,反应转移的电子数为2NA
C.1 mol [Co(NH3)6]Cl3含有σ键的数目为18NA
D.反应过程中有配位键的断裂和形成
答案 D
解析 NH3与Co3+形成配合物后,孤电子对与成键电子对的斥力转化为成键电子对间的斥力,斥力减小,键角增大,所以配合物中NH3分子键角大,A错误;H2O2中O元素化合价降低,产物H2O是还原产物,每生成1molH2O,反应转移的电子数为NA,B错误;1个[Co(NH3)6]3+中1个Co3+与6个N原子形成6个配位键,配位键属于σ键,每个NH3中含3个N—Hσ键,1mol[Co(NH3)6]3+中含有(6+6×3) mol=24molσ键,故1mol [Co(NH3)6]Cl3含有σ键的数目为24NA,C错误;反应过程中,铵根离子中的配位键断裂,[Co(NH3)6]Cl3中的配位键形成,D正确。

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享