n
第27练 无机化工流程热点题空突破
[分值:100分]
题空一操作单元原理与目的分析
1.(6分)工业上用高硫铝土矿(主要成分为Fe2O3、Al2O3、SiO2,少量FeS2)为原料制备聚合硫酸铁的部分工艺流程如下:
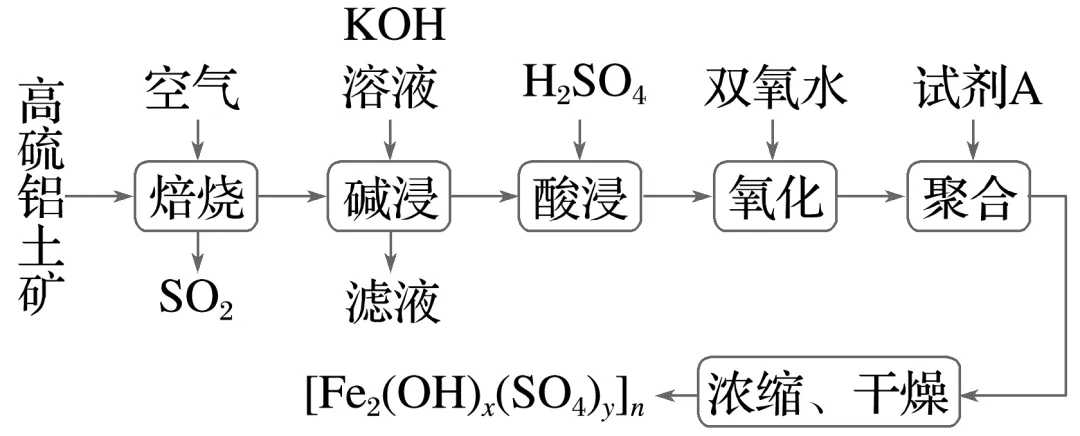
氧化过程中加入双氧水的目的为,
实际生产过程中温度不宜过高且要控制H2O2的投加速度,其原因为。
答案 将Fe2+氧化为Fe3+ 防止H2O2受热分解,提高原料利用率
解析氧化过程中加入H2O2的目的是将“酸浸”后溶液中的Fe2+氧化为Fe3+,离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O,双氧水不稳定,易分解,温度过高,双氧水分解速率加快,且溶液中的Fe3+可以催化H2O2分解,故实际生产过程中温度不宜过高且要控制H2O2的投加速度,防止H2O2分解影响原料利用率。
2.(14分)(2025·宁夏高三期中)铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
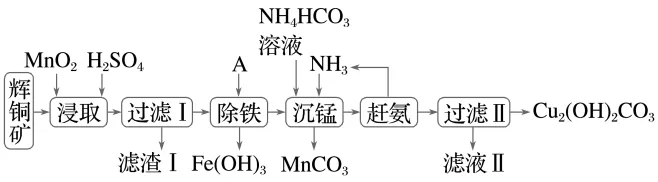
已知:常温下几种金属离子开始形成沉淀与完全沉淀时的pH如下表
物质 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
(1)为提高“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有(任写一种)。
(2)辉铜矿中亚铜离子的价电子排布式为。
(3)滤渣Ⅰ中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:。
(4)常温下“除铁”时加入的试剂A可以是, pH的调节范围为。
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是。
答案 (1)充分搅拌,将辉铜矿粉碎,加热等
(2)3d10 (3)Cu2S+2MnO2+8H+===2Cu2++2Mn2++S+4H2O (4)CuO(或氢氧化铜、碱式碳酸铜合理即可) 3.7~5.6(或3.7≤pH<5.6)
(5)取少量最后一次洗涤液于洁净的试管中,加入足量稀盐酸酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净,反之未洗净
解析经过第一步浸取,金属元素转化为相应硫酸盐,Cu2S被MnO2氧化为CuSO4和S,SiO2未溶解,故滤渣Ⅰ为过量的MnO2、S、SiO2,滤液中含有CuSO4、Fe2(SO4)3、MnSO4,经过除铁步骤,Fe3+被转化为沉淀除去,CuSO4和MnSO4进入沉锰步骤,Mn2+转化为沉淀除去,同时反应生成碱式碳酸铜。(2)Cu是第29号元素,价电子排布式为3d104s1,亚铜离子的价电子排布式为3d10。(3)根据元素守恒确定浸取时生成的S来源于Cu2S,说明Cu2S被MnO2氧化,结合后续流程推断此时Cu元素也被氧化,MnO2被还原为Mn2+,则反应为Cu2S+2MnO2+8H+===2Cu2++2Mn2++S+4H2O。(4)铁离子水解后溶液显酸性,加入的试剂既能减弱酸性,同时又不引入杂质离子,可加入CuO、Cu(OH)2、CuCO3等;调节pH为3.7~5.6(或3.7≤pH<5.6),使铁离子完全沉淀。(5)滤液Ⅱ中主要含有的盐为(NH4)2SO4,取少量最后一次洗涤液于洁净的试管中,是否洗净即判断溶液是否还含有硫酸根离子,操作是加入足量稀盐酸酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净,反之未洗净。
题空二工艺流程中的条件控制及原因分析
3.(14分)(2025·湖南衡阳高三联考)为解决钒、铬资源的利用问题,利用钒铬渣(含有V2O3、Cr2O3及SiO2、Fe2O3、FeO等)提取钒、铬的工艺流程:
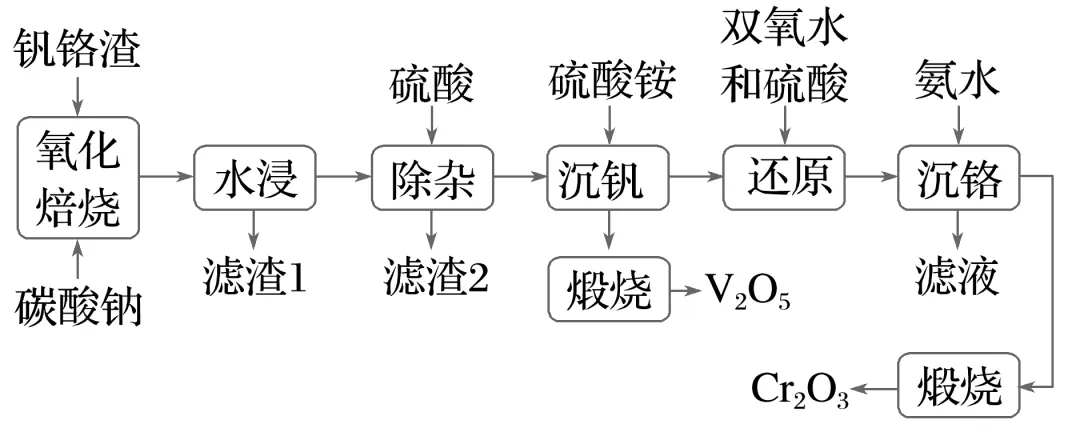
已知:25 ℃时,Cr(OH)3的溶度积常数为6.4×10-31;lg 4=0.6。
(1)“氧化焙烧”该步骤不能使用陶瓷容器,其原因是。
(2)加快“水浸”的速率,可以采取的措施:(写一种即可)。
(3)“除杂”产生的滤渣2的成分是(用化学式表示)。
(4)写出紧接“沉钒”的“煅烧”反应的化学方程式:。
(5)已知双氧水还原Cr2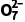 的效率在40 ℃时最高,解释原因:。
的效率在40 ℃时最高,解释原因:。
(6)“沉铬”过程中,室温下,当溶液的pH为5时,溶液中的Cr3+是否已完全沉淀?(列式计算)(已知溶液中离子浓度≤10-5 mol·L-1时认为已完全沉淀)。
答案 (1)陶瓷在高温下会与碳酸钠反应 (2)提高水浸温度,搅拌等 (3)H2SiO3 (4)2NH4VO3 2O5+2NH3↑+H2O (5)低于40 ℃,H2O2还原Cr2
2O5+2NH3↑+H2O (5)低于40 ℃,H2O2还原Cr2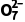 的反应速率随温度升高而增加;超过40℃,双氧水分解,浓度降低,导致还原Cr2
的反应速率随温度升高而增加;超过40℃,双氧水分解,浓度降低,导致还原Cr2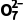 的反应速率降低 (6)Ksp
的反应速率降低 (6)Ksp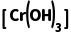 =c(Cr3+)·c3(OH-)=6.4×10-31,pH=5时,c(OH-)=10-9 mol·L-1,溶液中c(Cr3+)=
=c(Cr3+)·c3(OH-)=6.4×10-31,pH=5时,c(OH-)=10-9 mol·L-1,溶液中c(Cr3+)=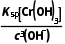 =
=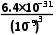 mol·L-1=6.4×10-4 mol·L-1>10-5 mol·L-1,所以沉淀不完全
mol·L-1=6.4×10-4 mol·L-1>10-5 mol·L-1,所以沉淀不完全
解析本流程中“氧化焙烧”步骤中V2O3、Cr2O3、SiO2分别转化为NaVO3、Na2CrO4、Na2SiO3,Fe2O3、FeO则变为Fe2O3,水浸后过滤出滤渣1为Fe2O3,向滤液中加入硫酸得到硅酸沉淀,过滤得到滤渣2为H2SiO3,加入硫酸铵沉淀钒元素,生成NH4VO3沉淀,对NH4VO3进行煅烧得到V2O5,反应的化学方程式为2NH4VO3 2O5+2NH3↑+H2O,向滤液中加入双氧水和硫酸,将Cr2
2O5+2NH3↑+H2O,向滤液中加入双氧水和硫酸,将Cr2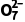 还原为Cr3+,然后加入氨水,沉淀铬得到Cr(OH)3,再对Cr(OH)3进行煅烧得到Cr2O3。
还原为Cr3+,然后加入氨水,沉淀铬得到Cr(OH)3,再对Cr(OH)3进行煅烧得到Cr2O3。
4.(16分)硫酸铈铵[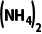 Ce
Ce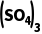 ]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用含铈矿石[主要成分为Ce2
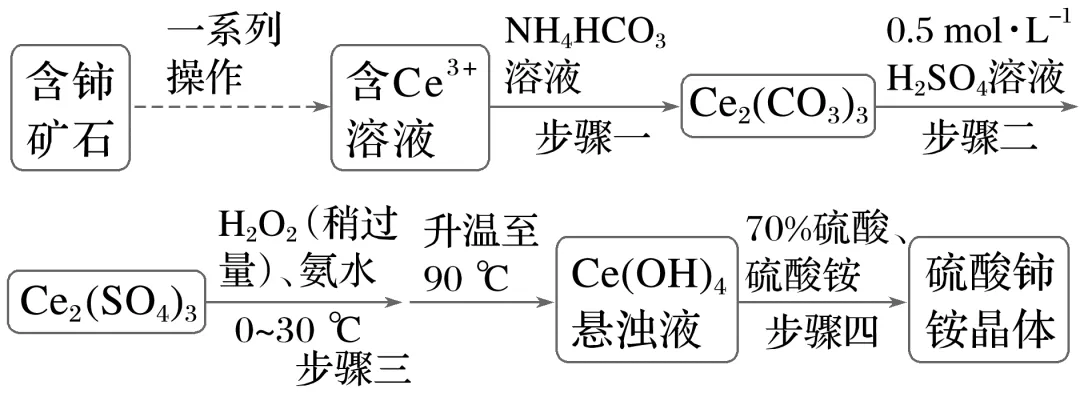
]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用含铈矿石[主要成分为Ce2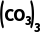 ]制备硫酸铈铵的工艺流程如图所示:
]制备硫酸铈铵的工艺流程如图所示:
已知:①Ksp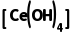 =2×10-48。
=2×10-48。
②硫酸铈铵的熔点为130 ℃,沸点为330 ℃。
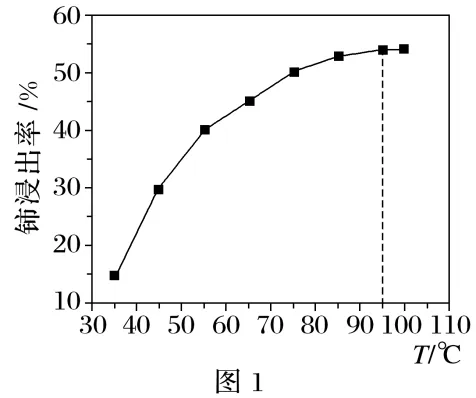
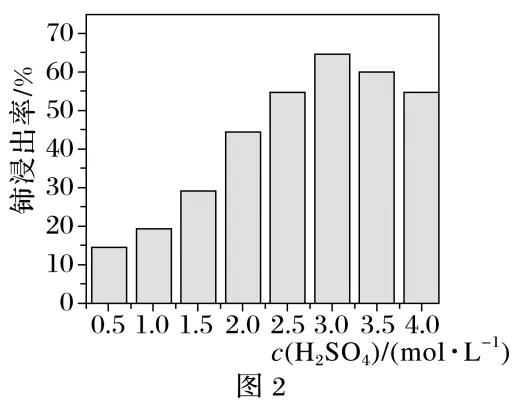
(1)含铈矿石进行的“一系列操作”包含用硫酸酸浸,其中铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜温度是℃,适宜的硫酸浓度是mol·L-1。
(2)步骤一中,发生反应的离子方程式为。
(3)步骤三中,反应生成Ce(OH)4的化学方程式为。
(4)步骤三在0~30 ℃反应完全后又升温至90 ℃的目的是。
(5)步骤四反应完全后的溶液经、、过滤,得到晶体,最后用洗涤2~3次后,得到高纯硫酸铈铵晶体。
答案 (1)95 3.0 (2)2Ce3++6 ===Ce2
===Ce2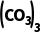 ↓+3CO2↑+3H2O (3)Ce2(SO4)3+H2O2+6NH3·H2O2Ce(OH)4↓+3(NH4)2SO4 (4)0~30 ℃反应是防止H2O2、氨水分解,后升温至90 ℃是除去过量的H2O2(合理即可) (5)蒸发浓缩 冷却结晶 乙醇
↓+3CO2↑+3H2O (3)Ce2(SO4)3+H2O2+6NH3·H2O2Ce(OH)4↓+3(NH4)2SO4 (4)0~30 ℃反应是防止H2O2、氨水分解,后升温至90 ℃是除去过量的H2O2(合理即可) (5)蒸发浓缩 冷却结晶 乙醇
解析含铈矿石经过一系列操作,Ce3+进入溶液中,加入NH4HCO3溶液得到Ce2(CO3)3沉淀,加入0.5mol·L-1H2SO4溶液得到Ce2(SO4)3溶液,加入过氧化氢、氨水在0~30℃将Ce3+氧化为Ce4+,然后升温至90℃得到Ce(OH)4悬浊液,加入70%硫酸、硫酸铵得到硫酸铈铵晶体。
题空三化工流程中的萃取与反萃取操作
5.(9分)实验室以二氧化铈(CeO2)废渣为原料制备Cl-含量少的Ce2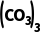 ,其部分实验过程如下:
,其部分实验过程如下:
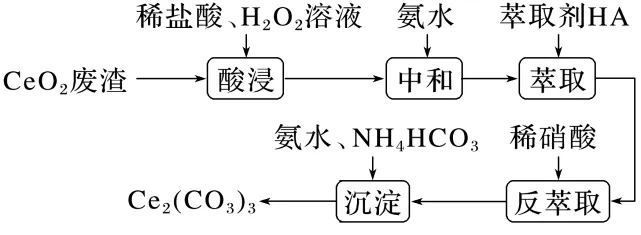
通过中和、萃取、反萃取、沉淀等过程,可制备Cl-含量少的Ce2(CO3)3。已知Ce3+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
Ce3+(水层)+3HA(有机层)Ce(A)3(有机层)+3H+(水层)
(1)加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是。
(2)反萃取的目的是将有机层Ce3+转移到水层。使Ce3+尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有(填两项)。
(3)与“反萃取”得到的水溶液比较,滤去Ce2(CO3)3沉淀的滤液中,物质的量减小的离子有(填化学式)。
答案 (1)降低溶液中氢离子的浓度,促进萃取反应平衡正向移动,提高Ce3+萃取率 (2)适当增大稀HNO3浓度、多次萃取分液 (3)Ce3+、H+
解析(1)由萃取原理知,酸性条件下Ce3+不易被HA萃取,加入氨水除去过量盐酸,便于Ce3+由水层进入有机层。(3)“反萃取”得到的水溶液中含有Ce3+、H+和N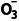 ,加入氨水、NH4HCO3后,消耗H+,Ce3+转化为沉淀,所以Ce3+和H+的物质的量减小。
,加入氨水、NH4HCO3后,消耗H+,Ce3+转化为沉淀,所以Ce3+和H+的物质的量减小。
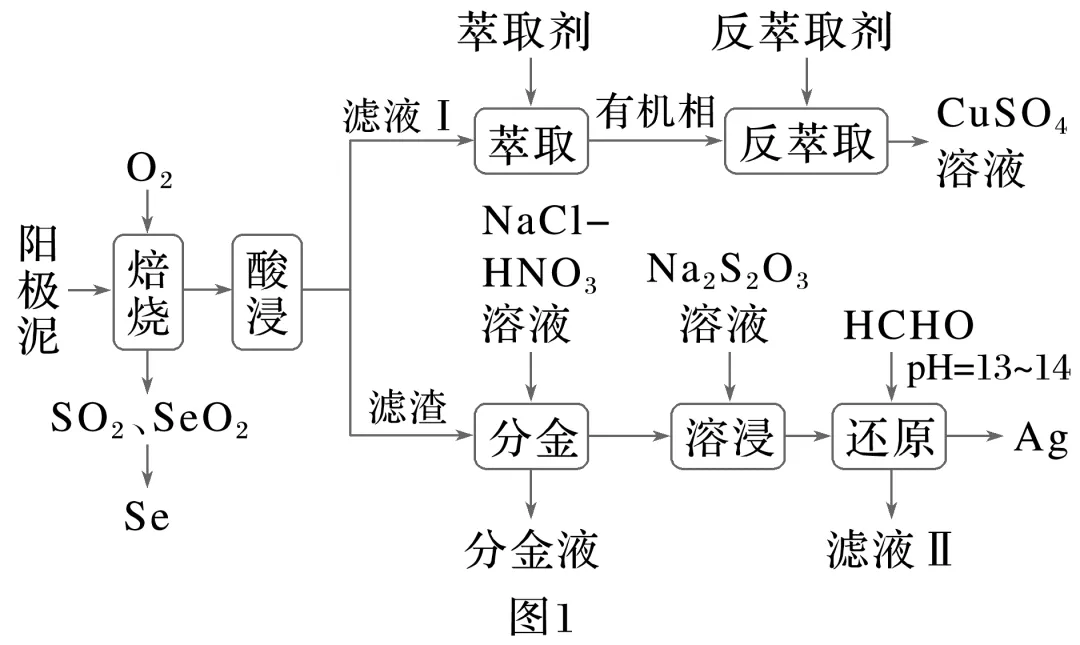
6.(8分)(2024·山东滨州二模)从阳极泥(主要成分有Cu、Ag、Au、Ag2Se、Cu2S和NiSO4等)中回收Se和金属的部分工艺流程如图1。
已知:
该工艺中萃取原理:2RH+

通过网盘分享的文件:2026版化学步步高大二轮专题复习【通用版】
链接: https://pan.baidu.com/s/1qU2fefC24s-mrlVQEwKSwQ?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享